Как определить коэффициент в химических уравнениях. Карточка-информатор. "Алгоритм расстановки коэффициентов в уравнениях химических реакций."
Для того чтобы выяснить, как уравнять химическое уравнение, для начала следует узнать предназначение данной науки.
Определение
Химия изучает вещества, их свойства, а также превращения. В случае если не наблюдается изменения окраски, выпадения осадка, выделения газообразного вещества, то не происходит никакого химического взаимодействия.
Например, при обработке напильником железного гвоздя металл просто превращается в порошок. В этом случае никакой химической реакции не происходит.
Прокаливание перманганата калия сопровождается образованием оксида марганца (4), выделением кислорода, то есть наблюдается взаимодействие. При этом возникает вполне закономерный вопрос о том, как правильно уравнивать химические уравнения. Разберем все нюансы, связанные с подобной процедурой.

Специфика химических превращений
Любые явления, которые сопровождаются изменением качественного и количественного состава веществ, относятся к химическим превращениям. В молекулярном виде процесс сгорания железа в атмосфере можно выразить с помощью знаков и символов.
Методика расстановки коэффициентов
Как уравнивать коэффициенты в химических уравнениях? В курсе химии средней школы разбирается метод электронного баланса. Рассмотрим процесс более подробно. Для начала в исходной реакции необходимо расставить степени окисления у каждого химического элемента.
Существуют определенные правила, по которым их можно определить у каждого элемента. В простых веществах степени окисления будут равны нулю. В бинарных соединениях у первого элемента она положительна, соответствует высшей валентности. У последнего данный параметр определяется путем вычитания номера группы из восьми и имеет знак «минус». В формулах, состоящих их трех элементов, есть свои нюансы вычисления степеней окисления.
Для первого и последнего элемента порядок аналогичен определению в бинарных соединениях, а для вычисления центрального элемента составляется уравнение. Сумма всех показателей должна быть равна нулю, исходя из этого, вычисляется показатель для среднего элемента формулы.
Продолжим разговор о том, как уравнивать химические уравнения методом электронного баланса. После того как степени окисления будут поставлены, можно определять те ионы либо вещества, которые в ходе химического взаимодействия изменили их значение.
Знаками «плюс» и «минус» необходимо указать количество электронов, которые были приняты (отданы) в процессе химического взаимодействия. Между полученными цифрами находят наименьшее общее кратное.
При делении его на принятые и отданные электроны получают коэффициенты. Как уравнять химическое уравнение? Полученные в балансе цифры нужно поставить перед соответствующими формулами. Обязательным условием является проверка количества каждого элемента в левой и правой части. Если коэффициенты расставлены правильно, их число должно быть одинаковым.

Закон сохранения массы веществ
Рассуждая над тем, как уравнять химическое уравнение, необходимо использовать именно этот закон. Учитывая, что масса тех веществ, которые вступили в химическую реакцию, равна массе образующихся продуктов, становится возможным постановка коэффициентов перед формулами. Например, как уравнять химическое уравнение, если вступают во взаимодействие простые вещества кальций и кислород, а после завершения процесса получается оксид?
Чтобы справиться с поставленной задачей, необходимо учитывать, что кислород является двухатомной молекулой с ковалентной неполярной связью, поэтому его формула записывается в следующем виде - О2. В правой части при составлении оксида кальция (СаО) учитывают валентности каждого элемента.
Сначала необходимо проверить количество кислорода в каждой части уравнения, так как оно отличается. По закону сохранения массы веществ перед формулой продукта нужно поставить коэффициент 2. Далее проводится проверка кальция. Для того чтобы он был уравнен, перед исходным веществом ставим коэффициент 2. В итоге получаем запись:
- 2Са+О2=2СаО.

Разбор реакции методом электронного баланса
Как уравнивать химические уравнения? Примеры ОВР помогут ответить на данный вопрос. Допустим, что необходимо методом электронного баланса расставить коэффициенты в предложенной схеме:
- CuO + Н2=Cu + Н2О.
Для начала у каждого из элементов в исходных веществах и продуктах взаимодействия расставим значения степеней окисления. Получим следующий вид уравнения:
- Cu(+2)О(-2)+Н2(0)=Cu(0)+Н2(+)О(-2).
Показатели изменились у меди и водорода. Именно на их основе будем составлять электронный баланс:
- Cu(+2)+2е=Cu(0) 1 восстановитель, окисление;
- Н2(0)-2е=2Н(+) 1 окислитель, восстановление.
Исходя из коэффициентов, полученных в электронном балансе, получаем следующую запись предложенного химического уравнения:
- CuO+Н2=Cu+Н2О.
Возьмем еще один пример, который предполагает постановку коэффициентов:
- Н2+О2=Н2О.
Для того чтобы уравнять на основе закона сохранения веществ данную схему, необходимо начать с кислорода. Учитывая, что вступала в реакцию двухатомная молекула, перед формулой продукта взаимодействия необходимо поставить коэффициент 2.
- 2Н2+О2=2Н2О.

Заключение
На основании электронного баланса можно расставлять коэффициенты в любых химических уравнениях. Выпускникам девятых и одиннадцатых классов образовательных учреждений, выбирающим экзамен по химии, в одном из заданий итоговых тестов предлагают подобные задания.
Алгоритм
Расстановка коэффициентов в уравнениях химических реакций
Учитель химии МБОУ ОСОШ №2
Володченко Светлана Николаевна
г Уссурийск
РАССТАНОВКА КОЭФФИЦИЭНТОВ В УРАВНЕНИЯХ ХИМИЧЕСКИХ РЕАКЦИЙ
Число атомов одного элемента в левой части уравнения должно быть равно числу атомов этого элемента в правой части уравнения.
Задание 1 (для групп). Определите число атомов каждого химического элемента, участвующего в реакции.
1. Вычислите число атомов:
а ) водорода : 8NH3, NaOH, 6NaOH, 2NaOH, НзРО 4, 2H2SO4, 3H2S04, 8H2SO4;
6) кислорода : C02, 3C02, 2C02, 6CO, H2SO4, 5H2SO4, 4H2S04, HN03.
2. Вычислите число атомов: а) водорода:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
б) кислорода:
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2H2O + O2
Алгоритм расстановки коэффициентов в уравнениях химических реакций
А1 + О2→ А12О3А1-1 атом А1-2
О-2 атома О-3
2. Среди элементов с разным числом атомов в левой и правой частях схемы выбрать тот, число атомов которого больше
О-2 атома слева
О-3 атома справа
3. Найти наименьшее общее кратное (НОК) числа атомов этого элемента в левой части уравнения и числа атомов этого элемента в правой части уравнения
НОК = 6
4. Разделить НОК на число атомов этого элемента в левой части уравнения, получить коэффициент для левой части уравнения
6:2 = 3
Аl + ЗО 2 →Аl 2 О 3
5. Разделить НОК на число атомов этого элемента в правой части уравнения, получить коэффициент для правой части уравнения
6:3 = 2
А1+ О 2 →2А1 2 О3
6. Если выставленный коэффициент изменил число атомов еще какого-либо элемента, то действия 3, 4, 5 повторить еще раз.
А1 + ЗО 2 → →2А1 2 О 3
А1 -1 атом А1 - 4
НОК = 4
4:1=4 4:4=1
4А1 + ЗО 2 → →2А1 2 О 3
. Первичная проверка усвоения знаний(8-10 мин .).
В левой части схемы два атома кислорода, а в правой - один. Число атомов нужно выровнять с помощью коэффициентов.
1)2Mg+O 2 →2MgO
2) СаСО 3 + 2HCl→ СаСl 2 + Н 2 О + СО 2
Задание 2 Расставьте коэффициенты в уравнениях химических реакций (обратите внимание, что коэффициент изменяет число атомов только одного элемента ):
1. Fe 2 O 3 + А l → А l 2 О 3 + Fe; Mg + N 2 → Mg 3 N 2 ;
2. Al + S → Al 2 S 3 ; A1 + С → Al 4 C 3 ;
3. Al + Cr 2 O 3 → Cr + Al 2 O 3 ; Ca + P → Ca 3 P 2 ;
4. С + H 2 → CH 4 ; Ca + С → СаС 2 ;
5. Fe + O 2 → Fe 3 O 4 ; Si + Mg → Mg 2 Si;
6/.Na + S → Na 2 S; CaO + С → CaC 2 + CO;
7. Ca + N 2 → C a 3 N 2 ; Si + Cl 2 → SiCl 4 ;
8. Ag + S → Ag 2 S; Н 2 + С l 2 → НС l;
9. N 2 + O 2 → NO; СО 2 + С → СО ;
10. HI → Н 2 → + 1 2 ; Mg + НС l → MgCl 2 + Н 2 ;
11. FeS + НС 1 → FeCl 2 + H 2 S; Zn+ HCl → ZnCl 2 + H 2 ;
12. Br 2 + KI → KBr+ I 2 ; Si + HF (r) → SiF 4 + H 2 ;
1./ HCl+Na 2 CO 3 → CO 2 +H 2 O+ NaCl; KClO 3 + S → → KCl+ SO 2 ;
14. Cl 2 + KBr → KCl + Br 2 ; SiO 2 + С → Si + CO;
15. SiO 2 + С → SiC + CO; Mg + SiO 2 → Mg 2 Si + MgO
16. Mg 2 Si + HCl → MgCl 2 + SiH 4
1.Что такое уравнение химической реакции?
2.Что записывают в правой части уравнения? А в левой?
3.Что означает знак «+» в уравнении?
4. Зачем расставляют коэффициенты в уравнениях хим
Существует несколько методов определения коэффициентов в уравнениях окислительно-восстановительных реакций. Мы используем метод электронного баланса, при котором составление полного уравнения ОВР проводится в следующей последовательности:
1. Составляют схему реакции, указав вещества, вступившие в реакцию, и вещества, получившиеся в результате реакции, например:
2. Определяют степень окисления атомов и пишут ее знак и величину над символами элементов, отмечая элементы, степень окисления которых изменилась:
3. Записывают электронные уравнения реакций окисления и восстановления, определяют число электронов, отданных восстановителем и принятых окислителем, и затем уравнивают их, умножая на соответствующие коэффициенты:
4. Полученные коэффициенты, отвечающие электронному балансу, переносят в основное уравнение:
5.Уравнивают число атомов и ионов, не меняющих степени окисления (в последовательности: металлы, неметаллы, водород):
6.Проверяют правильность подбора коэффициентов по числу атомов кислорода в левой и правой части уравнения реакции – они должны быть равны (в этом уравнении 24 = 18 + 2 + 4, 24 = 24).
Рассмотрим более сложный пример:
Определим степени окисления атомов в молекулах:
Составим электронные уравнения реакций окисления и восстановления и уравняем число отданных и принятых электронов:
Перенесем коэффициенты в основное уравнение:
Уравняем число атомов, не меняющих степень окисления:
Подсчитав число атомов кислорода в правой и левой части уравнения, убедимся, что коэффициенты подобраны правильно.
Важнейшие окислители и восстановители
Окислительно-восстановительные свойства элементов зависят от строения электронной оболочки атомов и определяются их положением в периодической системе Менделеева.
Металлы, имея на внешнем энергетическом уровне 1-3 электрона, легко их отдают и проявляют только восстановительные свойства. Неметаллы (элементы IV-VII групп) могут как отдавать, так и принимать электроны, поэтому они могут проявлять и восстановительные и окислительные свойства. В периодах с увеличением порядкового номера элемента восстановительные свойства простых веществ ослабевают, а окислительные усиливаются. В группах с повышением порядкового номера восстановительные свойства усиливаются, а окислительные ослабевают. Таким образом, из простых веществ лучшими восстановителями являются щелочные металлы, алюминий, водород, углерод; лучшими окислителями являются галогены и кислород .
Окислительно-восстановительные
свойства сложных веществ зависят от
степени окисления атомов, входящих в
их состав. Вещества,
содержащие атомы с низшей степенью
окисления, проявляют восстановительные
свойства
.
Важнейшими восстановителями являются
оксид углерода
 ,
сероводород
,
сероводород ,
сульфат железа(II)
,
сульфат железа(II)
 .Вещества,
в состав которых входят атомы с высшей
степенью окисления, проявляют окислительные
свойства
.
Важнейшими окислителями являются
перманганат калия
.Вещества,
в состав которых входят атомы с высшей
степенью окисления, проявляют окислительные
свойства
.
Важнейшими окислителями являются
перманганат калия
 ,
дихромат калия
,
дихромат калия ,
пероксид водорода
,
пероксид водорода ,
азотная кислота
,
азотная кислота ,
концентрированная серная кислота
,
концентрированная серная кислота .
.
Вещества,
содержащие атомы с промежуточной
степенью окисления, могут вести себя
как окислители или восстановители
в зависимости от свойств веществ, с
которыми они взаимодействуют, и условий
протекания реакции. Так в реакции с
 сернистая кислота проявляет
восстановительные свойства:
сернистая кислота проявляет
восстановительные свойства:
а при взаимодействии с сероводородом является окислителем:

Кроме того, для таких веществ возможны реакции самоокисления-самовосстановления, протекающие с одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента, например:
Сила многих
окислителей и восстановителей зависит
от рН среды. Например,
 в щелочной среде восстанавливается до
в щелочной среде восстанавливается до ,
в нейтральной до
,
в нейтральной до ,
в присутствии серной кислоты - до
,
в присутствии серной кислоты - до .
.
В уроке 13 «» из курса «Химия для чайников » рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
В результате реакции горения метана CH 4 в кислороде O 2 образуются диоксид углерода CO 2 и вода H 2 O. Эта реакция может быть описана химическим уравнением :
- CH 4 + O 2 → CO 2 + H 2 O (1)
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O 2 расходуется в расчете на 1 молекулу CH 4 и сколько молекул CO 2 и H2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
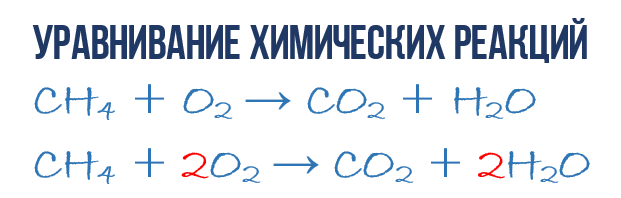
Начнем с углерода. В левой части один атом С входит в состав молекулы CH 4 , а в правой части один атом С входит в состав CO 2 . Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H 4 = 4H) в составе молекулы CH 4 , а в правой – всего 2 атома H в составе молекулы H 2 O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H 2 O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H 2 O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H 2 O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O или СH 4 + 2O 2 → CO 2 + 2H 2 O (4)
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C 7 H 5 N 3 O 6 энергично соединяется с кислородом, образуя H 2 O, CO 2 и N 2 . Запишем уравнение реакции, которое будем уравнивать:
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O 2 . Таким образом полное химическое уравнение будет иметь вид:
- 2C 7 H 5 N 3 O 6 + 10,5O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
- C 7 H 5 N 3 O 6 + 5,25O 2 → 7CO 2 + 2,5H 2 O + 1,5N 2 (10)
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты , а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро N A =6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O 2 с образованием 28 молей CO 2 , 10 молей H 2 O и 6 молей N 2 .
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O2 = 31,999 г/моль
- CO2 = 44,010 г/моль
- H2 O = 18,015 г/моль
- N2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO 2 , 10·18,015 г = 180,15 г H 2 O и 6·28,013 г = 168,08 г N 2 . Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO2 | |
| 671,98 г CO2 | 180,15 г H2 O | |
| 168,08 г N2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2 :
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO 3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 . Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO 3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl 2 (110,99 г/моль), CO 2 (44,01 г/моль) и H 2 O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO 3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
- CaCO 3 (тв.) + 2H + (водн.) → Ca 2+ (водн.) + CO 2 (г.) + H 2 O(ж.) (12)
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO 3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO 2 и H 2 O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений » вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
Сегодня мы поговорим о том, как расставлять коэффициенты в химических уравнениях. Данный вопрос интересует не только старшеклассников общеобразовательных учреждений, но и ребят, которые только знакомятся с основными элементами сложной и интересной науки. Если на первом этапе понять, в будущем проблем с решением задач не появится. Давайте разбираться с самого начала.
Что такое уравнение
Под ним принято подразумевать условную запись химической реакции, протекающей между выбранными реагентами. Для такого процесса используют индексы, коэффициенты, формулы.
Алгоритм составления
Как оформить химические уравнения? Примеры любых взаимодействий можно написать, суммируя исходные соединения. Знак равенства свидетельствует о том, что между реагирующими веществами протекает взаимодействие. Далее составляется формула продуктов по валентности (степени окисления).
Как записать реакцию
Например, если нужно записать химические уравнения, подтверждающие свойства метана, выбираем следующие варианты:
- галогенирование (радикальное взаимодействие с элементом VIIA периодической таблицы Д. И. Менделеева);
- горение в кислороде воздуха.
Для первого случая в левой части пишем исходные вещества, в правой - полученные продукты. После проверки числа атомов каждого химического элемента получаем конечную запись происходящего процесса. При горении метана в кислороде воздуха происходит экзотермический процесс, в результате которого образуется углекислый газ и водяной пар.
Для того чтобы правильно поставить коэффициенты в химических уравнениях, используется закон сохранения массы веществ. Начинаем процесс уравнивания с определения количества атомов углерода. Далее проводим расчеты для водорода и только после этого проверяем количество кислорода.
ОВР
Сложные химические уравнения можно уравнять, вооружившись методом электронного баланса или полуреакций. Предлагаем последовательность действий, предназначенную для расстановки коэффициентов в реакциях следующих типов:
- разложения;
- замещения.

Сначала важно расставить у каждого элемента в соединении степени окисления. При их расстановке необходимо учитывать некоторые правила:
- У простого вещества она равна нулю.
- В бинарном соединении их сумма равна 0.
- В соединении из трех и более элементов у первого проявляется положительная величина, у крайнего иона - отрицательное значение степени окисления. Центральный элемент высчитывают математическим путем, учитывая, что в сумме должен быть 0.
Далее выбирают те атомы либо ионы, у которых изменился показатель степени окисления. Знаками «плюс» и «минус» показывают количество электронов (принятых, отданных). Далее между ними определяется наименьшее кратное. При делении НОК на эти цифры получают числа. Данный алгоритм и будет ответом на вопрос о том, как расставлять коэффициенты в химических уравнениях.
Первый пример
Допустим, дано задание: «Расставьте коэффициенты в реакции, дополните пропуски, определите окислитель и восстановитель». Такие примеры предлагаются выпускникам школы, которые выбрали химию в качестве ЕГЭ.
KMnO 4 + H 2 SO 4 + KBr = MnSO 4 + Br 2 +…+…

Попробуем понять, как расставлять коэффициенты в химических уравнениях, предлагаемых будущим инженерам и медикам. После расстановки степеней окисления у элементов в исходных веществах и имеющихся продуктах получаем, что в качестве окислителя выступает ион марганца, а восстановительные свойства демонстрирует бромид-ион.
Делаем вывод о том, что пропущенные вещества не участвуют в окислительно-восстановительном процессе. Одним из недостающих продуктов является вода, а вторым станет сульфат калия. После составления электронного баланса завершающим этапом станет постановка коэффициентов в уравнении.
Второй пример
Приведем еще один пример, чтобы понять, как расставлять коэффициенты в химических уравнениях окислительно-восстановительного вида.
Допустим, дана следующая схема:
P + HNO 3 = NO 2 + … + …
Фосфор, который по условию является простым веществом, проявляет восстановительные свойства, повышая степень окисления до +5. Поэтому одним из пропущенных веществ будет фосфорная кислота H 3 PO 4. ОВР предполагает наличие восстановителя, которым будет выступать азот. Он переходит в оксид азота (4), образуя NO 2

Для того чтобы поставить в этой реакции коэффициенты, составим электронный баланс.
P 0 отдает 5e = P +5
N +5 принимает e = N +4
Учитывая, что перед азотной кислотой и оксидом азота (4) должен стоять коэффициент 5, получаем готовую реакцию:
P + 5HNO 3 =5NO 2 + H 2 O + H 3 PO 4
Стереохимические коэффициенты в химии позволяют решать разнообразные расчетные задачи.
Третий пример
Учитывая, что расстановка коэффициентов вызывает у многих старшеклассников затруднения, необходимо отрабатывать последовательность действий на конкретных примерах. Предлагаем еще один пример задания, выполнение которого предполагает владение методикой расстановки коэффициентов в окислительно-восстановительной реакции.
H 2 S + HMnO 4 = S + MnO 2 +…

Особенность предложенного задания в том, что необходимо дополнить пропущенный продукт реакции и только после этого можно переходить к постановке коэффициентов.
После расстановки степеней окисления у каждого элемента в соединениях можно сделать вывод, что окислительные свойства проявляет марганец, понижающий валентность. Восстановительную способность в предложенной реакции демонстрирует сера, восстанавливаясь до простого вещества. После составления электронного баланса нам останется только расставить коэффициенты в предлагаемую схему процесса. И дело сделано.
Четвертый пример
Химическое уравнение называют полным процессом в том случае, когда в нем в полном объеме соблюдается закон сохранения массы веществ. Как проверить эту закономерность? Количество атомов одного вида, которые вступили в реакцию, должно соответствовать их числу в продуктах взаимодействия. Только в этом случае можно будет вести речь о полноценности записанного химического взаимодействия, возможности его применения для проведения вычислений, решения расчетных задач разного уровня сложности. Приведем вариант задания, предполагающего расстановку в реакции недостающих стереохимических коэффициентов:
Si + …+ HF = H 2 SiF 6 + NO +…

Сложность задания в том, что пропущены и исходные вещества, и продукты взаимодействия. После постановки всех элементов степеней окисления видим, что восстановительные свойства проявляет в предлагаемом задании атом кремния. Среди продуктов реакции присутствует азот (II), одним из исходных соединений является азотная кислота. Логическим путем определяем, что недостающим продуктом реакции является вода. Завершающим этапом будет расстановка полученных стереохимических коэффициентов в реакцию.
3Si + 4HNO 3 + 18HF = 3H 2 SiF 6 + 4NO + 8 H 2 O
Пример задачи на уравнение
Нужно определить объем 10 % раствора хлороводорода, плотность которого составляет 1,05 г/мл, необходимый для полной нейтрализации гидроксида кальция, образующегося в процессе гидролиза его карбида. Известно, что газ, выделяющийся в ходе гидролиза, занимает объем 8,96 л (н. у.) Для того чтобы справиться с поставленным заданием, необходимо сначала составить уравнение процесса гидролиза карбида кальция:
CaC 2 + 2H 2 O = Ca (OH) 2 + C 2 H 2
Гидроксид кальция вступает во взаимодействие с хлороводородом, происходит полная нейтрализация:
Ca (OH) 2 + 2HCl = CaCl 2 + 2H 2 O

Вычисляем массу кислоты, которая потребуется для данного процесса. Определяем объем раствора хлороводорода. Все расчеты по задаче проводятся с учетом стереохимических коэффициентов, что подтверждает их важность.
В заключение
Анализ результатов единого государственного экзамена по химии свидетельствует о том, что задания, связанные с постановкой стереохимических коэффициентов в уравнениях, составление электронного баланса, определение окислителя и восстановителя вызывают серьезные затруднения у современных выпускников общеобразовательных школ. К сожалению, степень самостоятельности современных выпускников практически минимальна, поэтому отработку теоретической базы, предложенной педагогом, старшеклассники не проводят.
Среди типичных ошибок, которые допускают школьники, расставляя коэффициенты в реакциях разного типа, много математических погрешностей. Например, не все умеют находить наименьшее общее кратное, правильно делить и умножать числа. Причина подобного явления в уменьшении количества часов, выделяемых в образовательных школах на изучение данной темы. При базовой программе по химии у педагогов нет возможности отрабатывать со своими школьниками вопросы, касающиеся составления электронного баланса в окислительно-восстановительном процессе.











