Warum werden Koeffizienten in chemischen Gleichungen benötigt? So platzieren Sie Koeffizienten in chemischen Gleichungen. Analyse der Reaktion mit der Methode der elektronischen Waage
Es gibt verschiedene Methoden zur Bestimmung der Koeffizienten in den Gleichungen von Redoxreaktionen. Wir verwenden die Methode der elektronischen Waage, bei der die Erstellung der vollständigen OVR-Gleichung in der folgenden Reihenfolge erfolgt:
1. Erstellen Sie ein Reaktionsdiagramm, in dem Sie die reagierenden Stoffe und die aus der Reaktion resultierenden Stoffe angeben, zum Beispiel:
2. Bestimmen Sie den Oxidationszustand von Atomen und schreiben Sie dessen Vorzeichen und Wert über die Symbole der Elemente. Notieren Sie dabei die Elemente, deren Oxidationszustand sich geändert hat:
3. Schreiben Sie die elektronischen Gleichungen für die Oxidations- und Reduktionsreaktionen auf, bestimmen Sie die Anzahl der vom Reduktionsmittel abgegebenen und vom Oxidationsmittel aufgenommenen Elektronen und gleichen Sie sie dann durch Multiplikation mit den entsprechenden Koeffizienten aus:
4. Die erhaltenen Koeffizienten entsprechend der elektronischen Waage werden in die Hauptgleichung übertragen:
5. Gleichen Sie die Anzahl der Atome und Ionen aus, die den Oxidationszustand nicht ändern (in der Reihenfolge: Metalle, Nichtmetalle, Wasserstoff):
6. Überprüfen Sie die Richtigkeit der Auswahl der Koeffizienten anhand der Anzahl der Sauerstoffatome auf der linken und rechten Seite der Reaktionsgleichung – sie sollten gleich sein (in dieser Gleichung 24 = 18 + 2 + 4, 24 = 24).
Schauen wir uns ein komplexeres Beispiel an:
Lassen Sie uns die Oxidationsstufen von Atomen in Molekülen bestimmen:
Lassen Sie uns elektronische Gleichungen für Oxidations- und Reduktionsreaktionen erstellen und die Anzahl der gegebenen und akzeptierten Elektronen ausgleichen:
Übertragen wir die Koeffizienten auf die Hauptgleichung:
Lassen Sie uns die Anzahl der Atome ausgleichen, die den Oxidationszustand nicht ändern:
Indem wir die Anzahl der Sauerstoffatome auf der rechten und linken Seite der Gleichung zählen, stellen wir sicher, dass die Koeffizienten richtig gewählt sind.
Die wichtigsten Oxidations- und Reduktionsmittel
Die Redoxeigenschaften von Elementen hängen von der Struktur der elektronischen Hülle der Atome ab und werden durch ihre Position im Periodensystem von Mendelejew bestimmt.
Metalle mit 1-3 Elektronen auf dem äußeren Energieniveau geben diese leicht ab und zeigen nur reduzierende Eigenschaften. Nichtmetalle (Elemente der Gruppen IV–VII) können Elektronen sowohl abgeben als auch aufnehmen, sodass sie sowohl reduzierende als auch oxidierende Eigenschaften aufweisen können. In Zeiten mit zunehmender Ordnungszahl eines Elements schwächen sich die reduzierenden Eigenschaften einfacher Stoffe ab und die oxidierenden Eigenschaften nehmen zu. In Gruppen mit zunehmender Seriennummer nehmen die reduzierenden Eigenschaften zu und die oxidierenden Eigenschaften ab. Auf diese Weise, Von den einfachen Stoffen sind Alkalimetalle, Aluminium, Wasserstoff und Kohlenstoff die besten Reduktionsmittel. Die besten Oxidationsmittel sind Halogene und Sauerstoff.
Die Redoxeigenschaften komplexer Stoffe hängen vom Oxidationsgrad der Atome ab, aus denen sie bestehen. Stoffe, die Atome mit der niedrigsten Oxidationsstufe enthalten, weisen reduzierende Eigenschaften auf. Das wichtigste Reduktionsmittel ist Kohlenmonoxid  , Schwefelwasserstoff
, Schwefelwasserstoff  , Eisen(II)sulfat
, Eisen(II)sulfat  .Stoffe, die Atome mit der höchsten Oxidationsstufe enthalten, weisen oxidierende Eigenschaften auf. Das wichtigste Oxidationsmittel ist Kaliumpermanganat
.Stoffe, die Atome mit der höchsten Oxidationsstufe enthalten, weisen oxidierende Eigenschaften auf. Das wichtigste Oxidationsmittel ist Kaliumpermanganat  , Kaliumdichromat
, Kaliumdichromat  , Wasserstoffperoxid
, Wasserstoffperoxid  , Salpetersäure
, Salpetersäure  , konzentrierte Schwefelsäure
, konzentrierte Schwefelsäure  .
.
Stoffe, die Atome mit mittleren Oxidationsstufen enthalten, können als Oxidations- oder Reduktionsmittel wirken abhängig von den Eigenschaften der Stoffe, mit denen sie interagieren, und den Reaktionsbedingungen. Also als Reaktion auf  Schwefelige Säure weist reduzierende Eigenschaften auf:
Schwefelige Säure weist reduzierende Eigenschaften auf:
und bei Wechselwirkung mit Schwefelwasserstoff ist es ein Oxidationsmittel:

Darüber hinaus sind für solche Stoffe Selbstoxidations-Selbstreduktionsreaktionen möglich, die bei gleichzeitiger Zunahme und Abnahme der Oxidationsstufe von Atomen desselben Elements ablaufen, zum Beispiel:
Die Stärke vieler Oxidations- und Reduktionsmittel hängt vom pH-Wert des Mediums ab. Zum Beispiel, 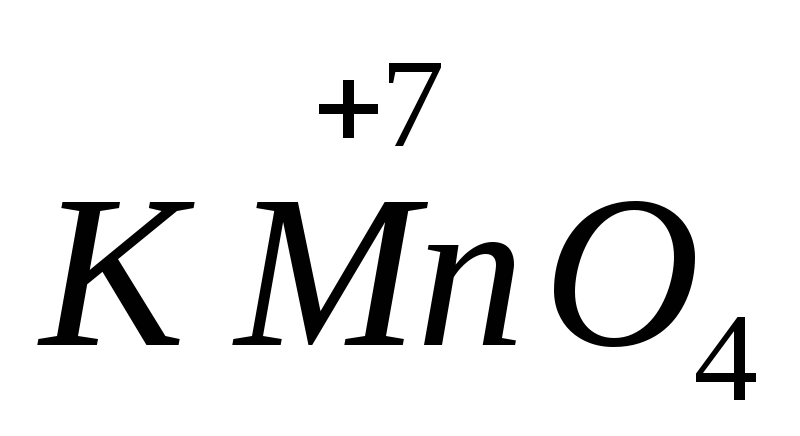 in einer alkalischen Umgebung wird es auf reduziert
in einer alkalischen Umgebung wird es auf reduziert  , in neutral zu
, in neutral zu  , in Gegenwart von Schwefelsäure - bis zu
, in Gegenwart von Schwefelsäure - bis zu  .
.
1. Lassen Sie uns ein Reaktionsdiagramm erstellen:
Lernziele.Lehrreich. Führen Sie die Schüler in eine neue Klassifizierung chemischer Reaktionen ein, die auf Änderungen der Oxidationsstufen von Elementen basiert – Oxidations-Reduktions-Reaktionen (ORR); Bringen Sie den Schülern bei, Koeffizienten mit der Methode der elektronischen Waage zu ordnen.
Entwicklung. Setzen Sie die Entwicklung des logischen Denkens, der Fähigkeit zum Analysieren und Vergleichen sowie die Bildung von Interesse am Thema fort.
Lehrreich. Das wissenschaftliche Weltbild der Studierenden formen; Arbeitsfähigkeiten verbessern.
Methoden und methodische Techniken. Geschichte, Gespräch, Demonstration visueller Hilfsmittel, selbstständiges Arbeiten der Studierenden.
Ausrüstung und Reagenzien. Reproduktion mit dem Bild des Koloss von Rhodos, Algorithmus zur Anordnung der Koeffizienten mithilfe der Methode der elektronischen Waage, Tabelle typischer Oxidations- und Reduktionsmittel, Kreuzworträtsel; Fe (Nagel), Lösungen von NaOH, CuSO4.
WÄHREND DES UNTERRICHTS
Einführender Teil
(Motivation und Zielsetzung)
Lehrer. Im 3. Jahrhundert. Chr. Auf der Insel Rhodos wurde ein Denkmal in Form einer riesigen Statue von Helios (dem griechischen Sonnengott) errichtet. Das grandiose Design und die perfekte Ausführung des Koloss von Rhodos – eines der Weltwunder – überraschten jeden, der ihn sah.
Wir wissen nicht genau, wie die Statue aussah, aber wir wissen, dass sie aus Bronze bestand und eine Höhe von etwa 33 m erreichte. Die Statue wurde vom Bildhauer Haret geschaffen und der Bau dauerte 12 Jahre.
Die Bronzeschale war an einem Eisenrahmen befestigt. Man begann mit dem Bau der hohlen Statue von unten, und während sie wuchs, wurde sie mit Steinen gefüllt, um sie stabiler zu machen. Etwa 50 Jahre nach seiner Fertigstellung stürzte der Koloss ein. Während des Erdbebens brach es in Kniehöhe.
Wissenschaftler glauben, dass der wahre Grund für die Zerbrechlichkeit dieses Wunders die Metallkorrosion war. Und der Korrosionsprozess basiert auf Redoxreaktionen.
Heute lernen Sie in der Lektion etwas über Redoxreaktionen; Erfahren Sie mehr über die Konzepte „Reduktionsmittel“ und „Oxidationsmittel“ sowie über die Prozesse der Reduktion und Oxidation. lernen, Koeffizienten in Gleichungen von Redoxreaktionen einzusetzen. Notieren Sie Datum und Thema der Lektion in Ihren Arbeitsbüchern.
Neues Material lernen
Der Lehrer führt zwei Demonstrationsexperimente durch: die Wechselwirkung von Kupfer(II)sulfat mit Alkali und die Wechselwirkung desselben Salzes mit Eisen.
Lehrer. Schreiben Sie die Molekülgleichungen für die durchgeführten Reaktionen auf. Ordnen Sie in jeder Gleichung die Oxidationsstufen der Elemente in den Formeln der Ausgangsstoffe und Reaktionsprodukte an.
Der Schüler schreibt Reaktionsgleichungen an die Tafel und ordnet Oxidationsstufen zu:
Lehrer. Änderten sich bei diesen Reaktionen die Oxidationsstufen der Elemente?
Student. In der ersten Gleichung änderten sich die Oxidationsstufen der Elemente nicht, in der zweiten jedoch – für Kupfer und Eisen.
Lehrer. Die zweite Reaktion ist eine Redoxreaktion. Versuchen Sie, Redoxreaktionen zu definieren.
Student. Reaktionen, die zu Änderungen der Oxidationsstufen der Elemente führen, aus denen die Reaktanten und Reaktionsprodukte bestehen, werden Redoxreaktionen genannt.
Die Schüler notieren in ihren Heften nach dem Diktat des Lehrers die Definition von Redoxreaktionen.
Lehrer. Was geschah als Ergebnis der Redoxreaktion? Vor der Reaktion hatte Eisen die Oxidationsstufe 0, nach der Reaktion wurde es +2. Wie wir sehen können, hat sich die Oxidationsstufe erhöht, daher gibt Eisen 2 Elektronen ab.
Kupfer hat vor der Reaktion einen Oxidationszustand von +2 und nach der Reaktion 0. Wie wir sehen können, hat sich der Oxidationszustand verringert. Daher nimmt Kupfer 2 Elektronen auf.
Eisen gibt Elektronen ab, es ist ein Reduktionsmittel und der Vorgang der Elektronenübertragung wird Oxidation genannt.
Kupfer nimmt Elektronen auf, es ist ein Oxidationsmittel und der Vorgang der Elektronenzufuhr wird Reduktion genannt.
Schreiben wir die Diagramme dieser Prozesse auf:
Geben Sie also eine Definition der Begriffe „Reduktionsmittel“ und „Oxidationsmittel“ an.
Student. Als Reduktionsmittel werden Atome, Moleküle oder Ionen bezeichnet, die Elektronen abgeben.
Atome, Moleküle oder Ionen, die Elektronen aufnehmen, werden Oxidationsmittel genannt.
Lehrer. Wie können wir die Prozesse der Reduktion und Oxidation definieren?
Student. Reduktion ist der Prozess, bei dem ein Atom, Molekül oder Ion Elektronen gewinnt.
Oxidation ist der Prozess der Elektronenübertragung durch ein Atom, Molekül oder Ion.
Die Schüler schreiben Definitionen aus dem Diktat in ein Notizbuch und zeichnen.
Erinnern!
Elektronen abgeben und oxidieren.
Elektronen nehmen – erholen.
Lehrer. Oxidation geht immer mit Reduktion einher, und umgekehrt ist Reduktion immer mit Oxidation verbunden. Die Anzahl der vom Reduktionsmittel abgegebenen Elektronen ist gleich der Anzahl der vom Oxidationsmittel aufgenommenen Elektronen.
Um Koeffizienten in den Gleichungen von Redoxreaktionen auszuwählen, werden zwei Methoden verwendet – das elektronische Gleichgewicht und das Elektron-Ionen-Gleichgewicht (Halbreaktionsmethode).
Wir betrachten nur die Methode der elektronischen Waage. Dazu verwenden wir einen Algorithmus zum Anordnen von Koeffizienten mithilfe der Methode der elektronischen Waage (entworfen auf einem Blatt Whatman-Papier).
BEISPIEL Ordnen Sie die Koeffizienten in diesem Reaktionsschema mithilfe der Methode der elektronischen Waage an, bestimmen Sie das Oxidationsmittel und das Reduktionsmittel und geben Sie die Prozesse der Oxidation und Reduktion an:
Fe2O3 + CO Fe + CO2.
Wir werden den Algorithmus zum Anordnen von Koeffizienten mithilfe der Methode der elektronischen Waage verwenden.
3. Schreiben wir die Elemente auf, die den Oxidationszustand ändern:
4. Lassen Sie uns elektronische Gleichungen erstellen und die Anzahl der abgegebenen und empfangenen Elektronen bestimmen:
5. Die Anzahl der abgegebenen und empfangenen Elektronen muss gleich sein, denn Weder die Edukte noch die Reaktionsprodukte werden geladen. Wir gleichen die Anzahl der abgegebenen und empfangenen Elektronen aus, indem wir das kleinste gemeinsame Vielfache (LCM) und zusätzliche Faktoren auswählen:
6. Die resultierenden Multiplikatoren sind Koeffizienten. Übertragen wir die Koeffizienten auf das Reaktionsschema:
Fe2O3 + 3CO = 2Fe + 3CO2.
Als typisch werden Stoffe bezeichnet, die bei vielen Reaktionen Oxidations- oder Reduktionsmittel sind.
Ein Tisch aus einem Stück Whatman-Papier wird aufgehängt.
Lehrer. Redoxreaktionen kommen sehr häufig vor. Sie sind nicht nur mit Korrosionsprozessen verbunden, sondern auch mit Fermentation, Zerfall, Photosynthese und Stoffwechselprozessen, die in einem lebenden Organismus ablaufen. Sie können bei der Kraftstoffverbrennung beobachtet werden.
So balancieren Sie eine chemische Gleichung: Regeln und Algorithmus
Redoxprozesse begleiten die Stoffkreisläufe in der Natur.
Wussten Sie, dass täglich etwa 2 Millionen Tonnen Salpetersäure in der Atmosphäre entstehen?
700 Millionen Tonnen pro Jahr und in Form einer schwachen Lösung fallen mit dem Regen auf den Boden (der Mensch produziert nur 30 Millionen Tonnen Salpetersäure pro Jahr).
Was passiert in der Atmosphäre?
Luft enthält 78 Vol.-% Stickstoff, 21 Vol.-% Sauerstoff und 1 Vol.-% andere Gase. Unter dem Einfluss von Blitzentladungen, und auf der Erde gibt es durchschnittlich 100 Blitze pro Sekunde, interagieren Stickstoffmoleküle mit Sauerstoffmolekülen und bilden Stickstoffmonoxid (II):
Stickstoffmonoxid(II) wird durch Luftsauerstoff leicht zu Stickstoffmonoxid(IV) oxidiert:
Das entstehende Stickoxid (IV) reagiert in Gegenwart von Sauerstoff mit der Luftfeuchtigkeit und wird zu Salpetersäure:
NO2 + H2O + O2 HNO3.
Alle diese Reaktionen sind Redoxreaktionen.
Übung . Ordnen Sie die Koeffizienten in den angegebenen Reaktionsschemata mithilfe der Methode der elektronischen Bilanz an, geben Sie das Oxidationsmittel, das Reduktionsmittel sowie die Oxidations- und Reduktionsprozesse an.
Lösung
1. Bestimmen wir die Oxidationsstufen der Elemente:
2. Lassen Sie uns die Symbole der Elemente hervorheben, deren Oxidationsstufen sich ändern:
3. Schreiben wir die Elemente auf, die ihre Oxidationsstufen geändert haben:
4. Lassen Sie uns elektronische Gleichungen erstellen (bestimmen Sie die Anzahl der abgegebenen und empfangenen Elektronen):
5. Die Anzahl der abgegebenen und empfangenen Elektronen ist gleich.
6. Übertragen wir die Koeffizienten der elektronischen Schaltkreise auf das Reaktionsdiagramm:
Als nächstes werden die Schüler gebeten, die Koeffizienten mithilfe der Methode der elektronischen Waage selbstständig zu ordnen, das Oxidationsmittel und das Reduktionsmittel zu bestimmen und die Oxidations- und Reduktionsprozesse in anderen in der Natur vorkommenden Prozessen anzugeben.
Die anderen beiden Reaktionsgleichungen (mit Koeffizienten) haben die Form:
Die Richtigkeit der Aufgaben wird mit einem Overheadprojektor überprüft.
Letzter Teil
Der Lehrer bittet die Schüler, ein Kreuzworträtsel auf der Grundlage des gelernten Materials zu lösen. Das Ergebnis der Arbeit wird zur Überprüfung vorgelegt.
Gelöst Kreuzworträtsel, erfahren Sie, dass die Stoffe KMnO4, K2Cr2O7, O3 stark sind... (vertikal (2)).
Waagerecht:
1. Welchen Prozess spiegelt das Diagramm wider:
3. Reaktion
N2 (g.) + 3H2 (g.) 2NH3 (g.) + Q
ist redox, reversibel, homogen, ....
4. ... Kohlenstoff(II) ist ein typisches Reduktionsmittel.
5. Welchen Prozess spiegelt das Diagramm wider:
6. Um Koeffizienten in den Gleichungen von Redoxreaktionen auszuwählen, verwenden Sie die elektronische... Methode.
7. Laut Diagramm gab Aluminium ... ein Elektron ab.
8. Als Reaktion:
H2 + Cl2 = 2HCl
Wasserstoff H2 – ... .
9. Welche Art von Reaktionen sind immer nur Redoxreaktionen?
10. Der Oxidationszustand einfacher Stoffe ist….
11. Als Reaktion:
Reduktionsmittel -….
Hausaufgabe.
Nach dem Lehrbuch von O.S. Gabrielyan „Chemistry-8“, § 43, S. 178–179, ex. 1, 7 schriftlich. Aufgabe (für zu Hause). Die Konstrukteure der ersten Raumschiffe und U-Boote standen vor einem Problem: Wie kann eine konstante Luftzusammensetzung auf Schiffen und Raumstationen aufrechterhalten werden? Überschüssiges Kohlendioxid loswerden und Sauerstoff auffüllen? Eine Lösung wurde gefunden.
Kaliumsuperoxid KO2 reagiert mit Kohlendioxid unter Bildung von Sauerstoff:
Wie Sie sehen, handelt es sich hierbei um eine Redoxreaktion. Sauerstoff ist bei dieser Reaktion sowohl ein Oxidationsmittel als auch ein Reduktionsmittel.
Bei einer Weltraummission zählt jedes Gramm Fracht. Berechnen Sie den Vorrat an Kaliumsuperoxid, der bei einem Raumflug mitgenommen werden muss, wenn der Flug 10 Tage dauert und die Besatzung aus zwei Personen besteht. Es ist bekannt, dass ein Mensch täglich 1 kg Kohlendioxid ausatmet.
(Antwort: 64,5 kg KO2. )
Aufgabe (erhöhter Schwierigkeitsgrad). Schreiben Sie die Gleichungen der Redoxreaktionen auf, die zur Zerstörung des Kolosses von Rhodos führen könnten. Bedenken Sie, dass diese riesige Statue in einer Hafenstadt auf einer Insel im Ägäischen Meer vor der Küste der heutigen Türkei stand, wo die feuchte Mittelmeerluft voller Salze ist. Es bestand aus Bronze (einer Legierung aus Kupfer und Zinn) und war auf einem Eisenrahmen montiert.
Literatur
Gabrielyan O.S.. Chemie-8. M.: Bustard, 2002;
Gabrielyan O.S., Voskoboynikova N.P., Yashukova A.V. Lehrerhandbuch. 8. Klasse. M.: Bustard, 2002;
Cox R., Morris N. Sieben Weltwunder. Die Antike, das Mittelalter, unsere Zeit. M.: BMM AO, 1997;
Kleines Kinderlexikon. Chemie. M.: Russische Enzyklopädische Partnerschaft, 2001; Enzyklopädie für Kinder „Avanta+“. Chemie. T. 17. M.: Avanta+, 2001;
Khomchenko G.P., Sevastyanova K.I. Redoxreaktionen. M.: Bildung, 1989.
S. P. Lebesheva,
Chemielehrer der Sekundarschule Nr. 8
(Baltijsk, Gebiet Kaliningrad)
Regeln für die Auswahl der Quoten:
- Wenn die Anzahl der Atome eines Elements in einem Teil des Reaktionsschemas gerade und im anderen ungerade ist, muss der Formel bei einer ungeraden Anzahl von Atomen ein Koeffizient von 2 vorangestellt werden, und dann die Anzahl aller Atome müssen ausgeglichen werden.
— Die Platzierung der Koeffizienten sollte mit dem Stoff mit der komplexesten Zusammensetzung beginnen und in der folgenden Reihenfolge erfolgen:
Zuerst müssen Sie die Anzahl der Metallatome ausgleichen, dann die Säurereste (Nichtmetallatome), dann die Wasserstoffatome und zuletzt die Sauerstoffatome.
— Wenn die Anzahl der Sauerstoffatome auf der linken und rechten Seite der Gleichung gleich ist, werden die Koeffizienten korrekt bestimmt.
- Danach kann der Pfeil zwischen den Gleichungsteilen durch ein Gleichheitszeichen ersetzt werden.
— Koeffizienten in der Gleichung chemische Reaktion darf keine gemeinsamen Teiler haben.
Beispiel. Lassen Sie uns eine Gleichung für die chemische Reaktion zwischen Eisen(III)-hydroxid und Schwefelsäure unter Bildung von Eisen(III)-sulfat erstellen.
1. Lassen Sie uns ein Reaktionsdiagramm erstellen:
Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
2. Wählen wir Koeffizienten für die Stoffformeln aus. Wir wissen, dass wir mit der komplexesten Substanz beginnen und im gesamten Schema nacheinander ausgleichen müssen, zuerst die Metallatome, dann die Säurereste, dann Wasserstoff und schließlich Sauerstoff. In unserem Schema ist Fe2(SO4)3 der komplexeste Stoff. Es enthält zwei Eisenatome und Fe(OH)3 enthält ein Eisenatom. Das bedeutet, dass Sie vor der Formel Fe(OH)3 einen Koeffizienten von 2 einsetzen müssen:
2Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O
Lassen Sie uns nun die Anzahl der sauren Reste von SO4 ausgleichen. Das Salz Fe2(SO4)3 enthält drei saure SO4-Reste. Das bedeutet, dass wir auf der linken Seite vor der Formel H2SO4 einen Koeffizienten von 3 setzen:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + H2O.
Lassen Sie uns nun die Anzahl der Wasserstoffatome ausgleichen. Auf der linken Seite des Diagramms in Eisenhydroxid 2Fe(OH)3 – 6 Wasserstoffatome (2
· 3), in Schwefelsäure 3H2SO4 gibt es auch 6 Wasserstoffatome.
So platzieren Sie Koeffizienten in chemischen Gleichungen
Auf der linken Seite befinden sich insgesamt 12 Wasserstoffatome. Das bedeutet, dass wir auf der rechten Seite der Wasserformel H2O den Koeffizienten 6 voranstellen – und nun stehen auf der rechten Seite auch 12 Wasserstoffatome:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
Es bleibt die Anzahl der Sauerstoffatome auszugleichen. Dies ist jedoch nicht mehr notwendig, da der linke und der rechte Teil des Diagramms bereits die gleiche Anzahl an Sauerstoffatomen aufweisen – jeweils 18. Das bedeutet, dass das Diagramm vollständig geschrieben ist und wir den Pfeil durch ein Gleichheitszeichen ersetzen können:
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O.
Ausbildung
Wie platziert man Koeffizienten in chemischen Gleichungen? Chemische Gleichungen
Heute werden wir darüber sprechen, wie man Koeffizienten in chemischen Gleichungen platziert. Diese Frage interessiert nicht nur Gymnasiasten allgemeinbildender Einrichtungen, sondern auch Kinder, die sich gerade mit den Grundelementen einer komplexen und interessanten Wissenschaft vertraut machen. Wenn Sie im ersten Schritt verstehen, wie man chemische Gleichungen schreibt, werden Sie in Zukunft keine Probleme mehr haben, Probleme zu lösen. Lassen Sie es uns von Anfang an herausfinden.
Wie lautet die Gleichung?
Darunter versteht man üblicherweise die herkömmliche Aufzeichnung einer chemischen Reaktion, die zwischen ausgewählten Reagenzien abläuft. Für einen solchen Prozess werden Indizes, Koeffizienten und Formeln verwendet.
Kompilierungsalgorithmus
Wie schreibt man chemische Gleichungen? Beispiele für beliebige Interaktionen können durch die Zusammenfassung der ursprünglichen Zusammenhänge geschrieben werden. Das Gleichheitszeichen zeigt an, dass eine Wechselwirkung zwischen den reagierenden Substanzen stattfindet. Als nächstes wird die Formel der Produkte nach Wertigkeit (Oxidationsstufe) zusammengestellt.
Video zum Thema
So zeichnen Sie eine Reaktion auf
Wenn Sie beispielsweise chemische Gleichungen aufschreiben müssen, die die Eigenschaften von Methan bestätigen, wählen Sie die folgenden Optionen:
- Halogenierung (radikalische Wechselwirkung mit Element VIIA des Periodensystems von D. I. Mendeleev);
- Verbrennung in Luftsauerstoff.

Für den ersten Fall schreiben wir auf der linken Seite die Ausgangsstoffe und auf der rechten Seite die resultierenden Produkte. Nachdem wir die Anzahl der Atome jedes chemischen Elements überprüft haben, erhalten wir die endgültige Aufzeichnung des laufenden Prozesses. Bei der Verbrennung von Methan in Sauerstoff kommt es zu einem exothermen Prozess, bei dem Kohlendioxid und Wasserdampf entstehen.
Um die Koeffizienten in chemischen Gleichungen richtig einzustellen, wird das Gesetz der Massenerhaltung von Stoffen verwendet. Wir beginnen den Ausgleichsprozess mit der Bestimmung der Anzahl der Kohlenstoffatome. Als nächstes führen wir Berechnungen für Wasserstoff durch und prüfen erst danach die Sauerstoffmenge.
OVR
Komplexe chemische Gleichungen können mit der Elektronenbilanz- oder Halbreaktionsmethode ausgeglichen werden. Wir bieten eine Abfolge von Aktionen zur Zuweisung von Koeffizienten für die folgenden Reaktionstypen an:

Zunächst ist es wichtig, die Oxidationsstufen jedes Elements in der Verbindung anzuordnen. Bei der Anordnung müssen einige Regeln beachtet werden:
- Für eine einfache Substanz ist es Null.
- In einer binären Verbindung ist ihre Summe 0.
- In einer Verbindung aus drei oder mehr Elementen weist das erste Ion einen positiven Wert und das äußerste Ion einen negativen Wert der Oxidationsstufe auf. Das zentrale Element wird mathematisch berechnet, wobei berücksichtigt wird, dass die Summe 0 sein muss.
Wählen Sie als Nächstes die Atome oder Ionen aus, deren Oxidationszustand sich geändert hat. Die Plus- und Minuszeichen geben die Anzahl der (empfangenen, abgegebenen) Elektronen an. Als nächstes wird das kleinste Vielfache zwischen ihnen ermittelt. Wenn man den NOC durch diese Zahlen dividiert, erhält man die Zahlen. Dieser Algorithmus wird die Antwort auf die Frage sein, wie Koeffizienten in chemischen Gleichungen platziert werden.
Erstes Beispiel
Nehmen wir an, die Aufgabe ist gegeben: „Ordnen Sie die Koeffizienten in der Reaktion, füllen Sie die Lücken aus, bestimmen Sie das Oxidationsmittel und das Reduktionsmittel.“ Solche Beispiele werden Schulabsolventen angeboten, die Chemie als Einheitliches Staatsexamen gewählt haben.
KMnO4 + H2SO4 + KBr = MnSO4 + Br2 +…+…

Versuchen wir zu verstehen, wie man Koeffizienten in chemischen Gleichungen platziert, die zukünftigen Ingenieuren und Ärzten angeboten werden. Nachdem wir die Oxidationsstufen der Elemente in den Ausgangsmaterialien und den verfügbaren Produkten geordnet haben, stellen wir fest, dass das Mangan-Ion als Oxidationsmittel wirkt und das Bromid-Ion reduzierende Eigenschaften aufweist.
Wir kommen zu dem Schluss, dass die fehlenden Substanzen nicht am Redoxprozess teilnehmen. Eines der fehlenden Produkte ist Wasser, das zweite Kaliumsulfat. Nach der Erstellung der elektronischen Waage erfolgt im letzten Schritt die Festlegung der Koeffizienten in der Gleichung.
Zweites Beispiel
Lassen Sie uns ein weiteres Beispiel geben, um zu verstehen, wie Koeffizienten in chemischen Gleichungen vom Redox-Typ platziert werden.
Angenommen, wir erhalten das folgende Diagramm:
P + HNO3 = NO2 +…+…
Phosphor, der per Definition eine einfache Substanz ist, weist reduzierende Eigenschaften auf und erhöht die Oxidationsstufe auf +5. Daher wird einer der fehlenden Stoffe Phosphorsäure H3PO4 sein. ORR geht von der Anwesenheit eines Reduktionsmittels aus, bei dem es sich um Stickstoff handelt. Es wird zu Stickstoffmonoxid (4) und bildet NO2

Um dieser Reaktion Koeffizienten zuzuweisen, erstellen wir eine elektronische Bilanz.
P0 ergibt 5e = P+5
N+5 nimmt e = N+4
Wenn man bedenkt, dass der Salpetersäure und dem Stickoxid (4) ein Koeffizient von 5 vorangestellt werden muss, erhalten wir die fertige Reaktion:
P + 5HNO3 =5NO2 + H2O + H3PO4
Stereochemische Koeffizienten in der Chemie ermöglichen die Lösung verschiedener Rechenprobleme.
Drittes Beispiel
Da die Anordnung der Koeffizienten vielen Oberstufenschülern Schwierigkeiten bereitet, ist es notwendig, den Handlungsablauf anhand konkreter Beispiele zu üben. Wir bieten ein weiteres Beispiel für eine Aufgabe an, deren Lösung Kenntnisse der Methodik zur Anordnung von Koeffizienten in einer Redoxreaktion erfordert.
H2S + HMnO4 = S + MnO2 +…

Die Besonderheit der vorgeschlagenen Aufgabe besteht darin, dass das fehlende Reaktionsprodukt ergänzt werden muss und erst danach mit der Einstellung der Koeffizienten fortgefahren werden kann.
Nachdem wir die Oxidationsstufen der einzelnen Elemente in den Verbindungen geordnet haben, können wir daraus schließen, dass Mangan oxidierende Eigenschaften aufweist und seine Wertigkeit verringert. Die Reduktionsfähigkeit der vorgeschlagenen Reaktion wird durch die Reduktion von Schwefel zu einer einfachen Substanz demonstriert. Nachdem wir die elektronische Waage erstellt haben, müssen wir nur noch die Koeffizienten im vorgeschlagenen Prozessdiagramm anordnen. Und es ist geschafft.
Viertes Beispiel
Eine chemische Gleichung wird als vollständiger Prozess bezeichnet, wenn darin das Gesetz der Massenerhaltung von Stoffen vollständig beachtet wird. Wie kann man dieses Muster überprüfen? Die Anzahl der an der Reaktion beteiligten Atome derselben Art muss ihrer Anzahl in den Reaktionsprodukten entsprechen. Nur in diesem Fall kann über den Nutzen der aufgezeichneten chemischen Wechselwirkung und die Möglichkeit ihrer Verwendung zur Durchführung von Berechnungen und zur Lösung von Rechenproblemen unterschiedlicher Komplexität gesprochen werden. Hier ist eine Variante der Aufgabe, bei der die fehlenden stereochemischen Koeffizienten in die Reaktion eingesetzt werden:
Si + …+ HF = H2SiF6 + NO +…

Die Schwierigkeit der Aufgabe besteht darin, dass sowohl die Ausgangsstoffe als auch die Reaktionsprodukte fehlen. Nachdem wir die Oxidationsstufen aller Elemente festgelegt haben, sehen wir, dass das Siliziumatom in der vorgeschlagenen Aufgabe reduzierende Eigenschaften aufweist. Unter den Reaktionsprodukten befindet sich Stickstoff (II); eine der Ausgangsverbindungen ist Salpetersäure. Wir stellen logischerweise fest, dass das fehlende Produkt der Reaktion Wasser ist. Der letzte Schritt besteht darin, die resultierenden stereochemischen Koeffizienten in die Reaktion einzubeziehen.
3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8 H2O
Beispiel für ein Gleichungsproblem
Es ist notwendig, das Volumen einer 10 %igen Chlorwasserstofflösung mit einer Dichte von 1,05 g/ml zu bestimmen, das erforderlich ist, um Calciumhydroxid, das bei der Hydrolyse seines Carbids entsteht, vollständig zu neutralisieren. Es ist bekannt, dass das bei der Hydrolyse freigesetzte Gas ein Volumen von 8,96 Litern (n.s.) einnimmt. Um die Aufgabe zu bewältigen, muss man zunächst eine Gleichung für den Hydrolyseprozess von Calciumcarbid aufstellen:
CaC2 + 2H2O = Ca (OH)2 + C2H2
Calciumhydroxid reagiert mit Chlorwasserstoff, es kommt zu einer vollständigen Neutralisation:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O

Wir berechnen die Säuremasse, die für diesen Prozess benötigt wird.
Koeffizienten und Indizes in chemischen Gleichungen
Bestimmen Sie das Volumen der Chlorwasserstofflösung. Alle Berechnungen für das Problem werden unter Berücksichtigung stereochemischer Koeffizienten durchgeführt, was ihre Bedeutung bestätigt.
Abschließend
Eine Analyse der Ergebnisse des Einheitlichen Staatsexamens in Chemie zeigt, dass Aufgaben im Zusammenhang mit der Festlegung stereochemischer Koeffizienten in Gleichungen, der Erstellung einer elektronischen Bilanz und der Bestimmung eines Oxidationsmittels und eines Reduktionsmittels modernen Absolventen weiterführender Schulen ernsthafte Schwierigkeiten bereiten. Leider ist der Grad der Unabhängigkeit moderner Absolventen nahezu gering, sodass Gymnasiasten die vom Lehrer vorgeschlagenen theoretischen Grundlagen nicht in die Praxis umsetzen.
Zu den typischen Fehlern, die Schulkinder bei der Anordnung von Koeffizienten in Reaktionen unterschiedlicher Art machen, gehören viele mathematische Fehler. Beispielsweise weiß nicht jeder, wie man das kleinste gemeinsame Vielfache findet oder Zahlen richtig dividiert und multipliziert. Der Grund für dieses Phänomen ist ein Rückgang der Stundenzahl, die in pädagogischen Schulen für das Studium dieses Themas vorgesehen ist. Im Grundlehrplan Chemie haben Lehrer nicht die Möglichkeit, mit ihren Schülern an Fragen der Herstellung des elektronischen Gleichgewichts im Redoxprozess zu arbeiten.
Ausbildung
Was ist ein Quadrat? Wie finde ich die Eckpunkte, den Schnitt, die Ebene, die Gleichung, das Volumen, die Grundfläche und den Winkel eines Quadrats?
Auf die Frage, was ein Quadrat ist, kann es viele Antworten geben. Es hängt alles davon ab, an wen Sie diese Frage gerichtet haben. Ein Musiker würde sagen, dass ein Quadrat aus 4, 8, 16, 32 Takten oder Jazzimprovisation besteht. Kind - was ist das...
Autos
Wie oft sollte man das Frostschutzmittel im Auto wechseln?
Wenn ein Automotor läuft, erreicht die Temperatur der Gase in seinen Zylindern 2000 Grad. Dadurch kommt es zu einer starken Erwärmung der Triebwerksteile. Um überschüssige Wärme vom Motor abzuführen...
Autos
Wie funktioniert der Thermostat in einem Auto? Funktionsprinzip
Kein modernes Auto kommt ohne Kühlsystem aus. Sie nimmt bei der Verarbeitung des brennbaren Gemisches die gesamte vom Motor ausgehende Wärme auf. Die Kolben bewegen sich, das Gemisch verbrennt, also braucht man eine gute...
Autos
Wie lade ich die Klimaanlage in einem Auto mit eigenen Händen auf? Wie oft müssen Sie die Klimaanlage Ihres Autos aufladen? Wo kann ich die Klimaanlage in meinem Auto aufladen?
Eine Autoklimaanlage ist heutzutage nicht nur ein Luxus, sondern ein notwendiges Gerät für ein Fahrzeug, das für ein günstiges Mikroklima im Innenraum verantwortlich ist. Fast alle modernen Automodelle sind ausgestattet, wenn nicht mit Klimaanlage...
Autos
Wie reinige ich die Klimaanlage in einem Auto mit eigenen Händen?
Autobesitzer müssen ständig auf den Zustand der Hauptteile und Mechanismen ihres Fahrzeugs achten. Denn wenn Sie sie sauber und in gutem Zustand halten, erreichen Sie ein optimales Maß an Sicherheit ...
Autos
Getriebeöl 80W90: Eigenschaften, Auswahl, Bewertungen. Welche Art von Öl sollte ich in ein Schaltgetriebe einfüllen?
Das Getriebeöl 80W90, dessen Eigenschaften wir heute betrachten werden, lässt sich als durchschnittlich zwischen den Viskositätsklassen 85W90 und 75W90 einordnen. Lassen Sie uns genauer herausfinden, welche qualitativen Merkmale sie voneinander unterscheiden ...
Autos
Welches Öl sollte ich in die Servolenkung einfüllen? Tipps zum Wechseln des Servolenkungsöls
Die Servolenkung erfordert wie andere Komponenten und Baugruppen des Fahrzeugs eine regelmäßige Wartung. Oftmals beschränken sich alle vorbeugenden Maßnahmen auf den Austausch der Arbeitsflüssigkeit. Oft braucht man einfach...
Autos
Wie bezahle ich das Parken in Moskau? Regeln für gebührenpflichtiges Parken
Um Moskauer Autofahrern das Leben deutlich zu erleichtern, wurden gebührenpflichtige Parkregeln geschaffen. Es ist kein Geheimnis, dass das Parken eines Fahrzeugs in der Hauptstadt gar nicht so einfach ist: Die Straßenränder der Stadt sind voller Autos …
Autos
Wie man mit eigenen Händen Autodüfte herstellt
Jeder Autobesitzer möchte, dass im Innenraum seines eisernen Pferdes immer ein angenehmer und beliebter Duft vorhanden ist. Manche Menschen mögen den Duft von Kaffee, manche mögen Zitrusfrüchte und manche mögen Frische. Was für Aromen...
Autos
Wie lade ich eine Batterie zu Hause auf?
Wahrscheinlich kennt jeder Autobesitzer schon einmal das Problem einer leeren Batterie. Dieses Problem kann jedem Autofahrer passieren, wenn er der Stromquelle des Autos nicht genügend Aufmerksamkeit schenkt.
VARIANTE 1
a) Na + O2 -> Na2O d) H2 + F2 -> HF
b) CaCO3 -> CaO + CO2 e) H2O + K2O -> KOH
c) Zn + H2SO4 -> H2 + ZnSO4 e) Cu(OH)2 + HNO3 -> Cu(NO3)2 + H2O
Lektion 13. Chemische Gleichungen schreiben
Schreiben Sie die Definitionen auf:
a) Verbindungsreaktion b) exotherme Reaktion c) irreversible Reaktion.
a) Kohlenstoff reagiert mit Sauerstoff und es entsteht Kohlenmonoxid (II);
b) Magnesiumoxid reagiert mit Salpetersäure und es entstehen Magnesiumnitrat und Wasser;
c) Eisen(III)-hydroxid zerfällt in Eisen(III)-oxid und Wasser;
d) Methan CH4 verbrennt in Sauerstoff und erzeugt Kohlenmonoxid (IV) und Wasser;
e) Stickstoffmonoxid (V) bildet beim Auflösen in Wasser Salpetersäure.
4. Lösen Sie das Problem mit der Gleichung:
a) Welche Menge Fluorwasserstoff entsteht, wenn Wasserstoff mit Fluor reagiert?
b) Welche Masse an Calciumoxid entsteht bei der Zersetzung von Kalkstein mit 80 % CaCO3?
c) Welches Volumen und welche Masse an Wasserstoff wird freigesetzt, wenn Zink mit 35 % Verunreinigungen mit Schwefelsäure reagiert?
OPTION 2
- Ordnen Sie die Koeffizienten, bestimmen Sie die Art der chemischen Reaktion, notieren Sie die Namen der Stoffe unter den Formeln:
a) P + O2 -> P2O5 d) H2 + N2 -> NH3
b) CaCO3 + HCl -> CaCl2 + H2O + CO2 e) H2O + Li2O -> LiOH
c) Mg + H2SO4 -> H2 + Mg SO4 e) Ca(OH)2 + HNO3 -> Ca(NO3)2 + H2O
2. Schreiben Sie die Definitionen auf:
a) Zersetzungsreaktion b) endotherme Reaktion c) katalytische Reaktion.
3. Schreiben Sie die Gleichungen wie beschrieben auf:
a) Kohlenstoff reagiert mit Sauerstoff und es entsteht Kohlenmonoxid (IV);
b) Bariumoxid reagiert mit Salpetersäure und es entstehen Bariumnitrat und Wasser;
c) Aluminiumhydroxid zerfällt in Aluminiumoxid und Wasser;
d) Ammoniak NH3 verbrennt unter Sauerstoff und es entstehen Stickstoff und Wasser;
e) Phosphor(V)oxid bildet, wenn es in Wasser gelöst wird, Phosphorsäure.
4. Lösen Sie das Problem mit der Gleichung:
a) Welche Menge Ammoniak entsteht bei der Reaktion von Wasserstoff mit Stickstoff?
b) Welche Masse an Calciumchlorid entsteht, wenn Marmor mit 80 % CaCO3 mit Salzsäure reagiert?
c) Welches Volumen und welche Masse an Wasserstoff wird freigesetzt, wenn Magnesium mit 30 % Verunreinigungen mit Schwefelsäure reagiert?
 Wie schreibt man chemische Gleichungen? Zunächst ist es wichtig, die Oxidationsstufen jedes Elements in der Verbindung anzuordnen. Nehmen wir an, die Aufgabe ist gegeben: „Ordnen Sie die Koeffizienten in der Reaktion, füllen Sie die Lücken aus, bestimmen Sie das Oxidationsmittel und das Reduktionsmittel.“ Eines der fehlenden Produkte ist Wasser, das zweite Kaliumsulfat. Nach der Erstellung der elektronischen Waage erfolgt im letzten Schritt die Festlegung der Koeffizienten in der Gleichung. Alle Berechnungen für das Problem werden unter Berücksichtigung stereochemischer Koeffizienten durchgeführt, was ihre Bedeutung bestätigt. Zu den typischen Fehlern, die Schulkinder bei der Anordnung von Koeffizienten in Reaktionen unterschiedlicher Art machen, gehören viele mathematische Fehler.
Wie schreibt man chemische Gleichungen? Zunächst ist es wichtig, die Oxidationsstufen jedes Elements in der Verbindung anzuordnen. Nehmen wir an, die Aufgabe ist gegeben: „Ordnen Sie die Koeffizienten in der Reaktion, füllen Sie die Lücken aus, bestimmen Sie das Oxidationsmittel und das Reduktionsmittel.“ Eines der fehlenden Produkte ist Wasser, das zweite Kaliumsulfat. Nach der Erstellung der elektronischen Waage erfolgt im letzten Schritt die Festlegung der Koeffizienten in der Gleichung. Alle Berechnungen für das Problem werden unter Berücksichtigung stereochemischer Koeffizienten durchgeführt, was ihre Bedeutung bestätigt. Zu den typischen Fehlern, die Schulkinder bei der Anordnung von Koeffizienten in Reaktionen unterschiedlicher Art machen, gehören viele mathematische Fehler.
Es gibt bestimmte Regeln, nach denen sie für jedes Element bestimmt werden können. Formeln, die aus drei Elementen bestehen, haben ihre eigenen Nuancen bei der Berechnung der Oxidationsstufen. Lassen Sie uns das Gespräch darüber fortsetzen, wie man chemische Gleichungen mithilfe der Methode der elektronischen Waage ausgleicht. Voraussetzung ist die Überprüfung der Menge jedes Elements auf der linken und rechten Seite. Wenn die Koeffizienten richtig platziert sind, sollte ihre Anzahl gleich sein.
Algebraische Methode
Lesen Sie unbedingt über die Elementaranalyse, um einen detaillierten Einblick in empirische Formeln und chemische Analysen zu erhalten.
Die Chemie untersucht Stoffe, ihre Eigenschaften und Umwandlungen. In molekularer Form kann der Prozess der Eisenverbrennung in der Atmosphäre durch Zeichen und Symbole ausgedrückt werden. Nach dem Massenerhaltungssatz von Stoffen muss der Produktformel ein Koeffizient von 2 vorangestellt werden. Als nächstes wird Kalzium überprüft. Zunächst werden wir den einzelnen Elementen in den Ausgangsstoffen und Reaktionsprodukten Oxidationsstufen zuordnen. Als nächstes wird der Wasserstoff getestet.
Ausgleich chemischer Reaktionen
Die Gleichsetzung chemischer Reaktionen ist notwendig, um aus einer einfachen chemischen Gleichung eine vollständige Gleichung zu erhalten. Beginnen wir mit Kohlenstoff.
Der Massenerhaltungssatz schließt die Entstehung neuer Atome und die Zerstörung alter Atome während einer chemischen Reaktion aus. Achten Sie auf den Index jedes Atoms; er gibt deren Nummer an. Durch das Hinzufügen von Indizes vor den Stoffmolekülen auf der rechten Seite der Gleichung haben wir auch die Anzahl der Sauerstoffatome verändert. Nun ist die Anzahl aller Kohlenstoff-, Wasserstoff- und Sauerstoffatome auf beiden Seiten der Gleichung gleich.
Sie sagen, dass, wenn ein Faktor hinter einer Klammer steht, jedes Element in der Klammer damit multipliziert wird. Sie müssen mit Stickstoff beginnen, da davon weniger vorhanden ist als Sauerstoff und Wasserstoff. Großartig, Wasserstoff ausgeglichen. Als nächstes kommt Barium. Es ist ausgeglichen, Sie müssen es nicht berühren. Vor der Reaktion gibt es zwei Chloratome, danach nur noch eines. Was getan werden muss? Aufgrund des gerade eingestellten Koeffizienten erhielten wir nach der Reaktion zwei Natriumatome und vor der Reaktion auch zwei. Super, alles andere ist ausgeglichen. Der nächste Schritt besteht darin, die Oxidationsstufen aller Elemente in jeder Substanz zu ordnen, um zu verstehen, wo Oxidation und wo Reduktion stattgefunden hat.

Beispiel für die Analyse einfacher Reaktionen
Auf der rechten Seite gibt es keine Indizes, also ein Sauerstoffteilchen, und auf der linken Seite sind 2 Teilchen. Es können keine zusätzlichen Indizes oder Korrekturen an der chemischen Formel vorgenommen werden, da diese korrekt geschrieben ist. Auf der rechten Seite multiplizieren wir eins mit 2, um dort 2 Sauerstoffionen zu erhalten.
Bevor Sie mit der eigentlichen Aufgabe beginnen, müssen Sie verstehen, dass die Zahl, die vor einem chemischen Element oder der gesamten Formel steht, als Koeffizient bezeichnet wird. Beginnen wir mit der Analyse. Das Ergebnis ist also die gleiche Anzahl von Atomen jedes Elements vor und nach dem Gleichheitszeichen. Beachten Sie unbedingt, dass der Koeffizient mit dem Index multipliziert und nicht addiert wird.
Unter folgenden Bedingungen ist es Ihnen gestattet, jedes Dokument frei für Ihre eigenen Zwecke zu verwenden:
2) Die Symbole chemischer Elemente sollten streng in der Form geschrieben werden, in der sie im Periodensystem erscheinen.
Informationskarte. „Algorithmus zur Anordnung von Koeffizienten in chemischen Reaktionsgleichungen.“
3) Gelegentlich treten Situationen auf, in denen die Formeln von Reaktanten und Produkten absolut korrekt geschrieben sind, die Koeffizienten jedoch immer noch nicht zugewiesen sind. Am wahrscheinlichsten tritt ein solches Problem bei Oxidationsreaktionen organischer Substanzen auf, bei denen das Kohlenstoffgerüst zerrissen wird.
Sie müssen in der Lage sein, die Reaktionsgleichung nicht nur zu schreiben, sondern auch zu lesen. Daher muss man manchmal, nachdem man alle Formeln in der Reaktionsgleichung geschrieben hat, die Anzahl der Atome in jedem Teil der Gleichung ausgleichen und die Koeffizienten festlegen. Zählen Sie, ob auf der linken und rechten Seite der Gleichung die gleiche Anzahl von Atomen jedes Elements vorhanden ist.
Für viele Schulkinder ist es keine leichte Aufgabe, Gleichungen chemischer Reaktionen zu schreiben und Koeffizienten richtig anzuordnen. Aber Sie müssen sich nur ein paar einfache Regeln merken, und die Aufgabe wird keine Schwierigkeiten mehr bereiten. Der Koeffizient, also die Zahl vor der Formel eines chemischen Moleküls, gilt für alle Symbole und wird mit jedem Index jedes Symbols multipliziert!
Algorithmus
Anordnung der Koeffizienten in chemischen Reaktionsgleichungen
Chemielehrer MBOU Sekundarschule Nr. 2
Wolodtschenko Swetlana Nikolajewna
Ussurijsk
Anordnung der Koeffizienten in Gleichungen chemischer Reaktionen
Die Anzahl der Atome eines Elements auf der linken Seite der Gleichung muss gleich der Anzahl der Atome dieses Elements auf der rechten Seite der Gleichung sein.
Aufgabe 1 (für Gruppen).Bestimmen Sie die Anzahl der Atome jedes an der Reaktion beteiligten chemischen Elements.
1. Berechnen Sie die Anzahl der Atome:
A) Wasserstoff: 8NH3, NaOH, 6NaOH, 2NaOH,Neuseeland4, 2H2SO4, 3H2S04, 8H2SO4;
6) Sauerstoff: C02, 3C02, 2C02, 6CO, H2SO4, 5H2SO4, 4H2S04, HN03.
2. Berechnen Sie die Anzahl der Atome: a)Wasserstoff:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
b) Sauerstoff:
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2H2O + O2
Algorithmus zur Anordnung von Koeffizienten in chemischen Reaktionsgleichungen
А1 + О2→ А12О3A1-1 Atom A1-2
O-2-Atom O-3
2. Wählen Sie unter den Elementen mit unterschiedlicher Atomzahl im linken und rechten Teil des Diagramms dasjenige aus, dessen Atomzahl größer ist
O-2-Atome links
O-3-Atome rechts
3. Finden Sie das kleinste gemeinsame Vielfache (LCM) der Anzahl der Atome dieses Elements auf der linken Seite der Gleichung und der Anzahl der Atome dieses Elements auf der rechten Seite der Gleichung
LCM = 6
4. Teilen Sie die LCM durch die Anzahl der Atome dieses Elements auf der linken Seite der Gleichung und erhalten Sie den Koeffizienten für die linke Seite der Gleichung
6:2 = 3
Al + ZO 2 →Al 2 UM 3
5. Teilen Sie die LCM durch die Anzahl der Atome dieses Elements auf der rechten Seite der Gleichung und erhalten Sie den Koeffizienten für die rechte Seite der Gleichung
6:3 = 2
A1+ O 2 →2A1 2 O3
6. Wenn der eingestellte Koeffizient die Anzahl der Atome eines anderen Elements verändert hat, wiederholen Sie die Schritte 3, 4, 5 erneut.
A1 + ZO 2 → →2À1 2 UM 3
A1 -1 Atom A1 - 4
LCM = 4
4:1=4 4:4=1
4A1 + ZO 2 → →2A1 2 UM 3
. Primärtest zum Wissenserwerb (8-10 Min.) .).
Auf der linken Seite des Diagramms befinden sich zwei Sauerstoffatome und auf der rechten eines. Die Anzahl der Atome muss mithilfe von Koeffizienten ausgeglichen werden.
1)2Mg+O2 →2MgO
2) CaCO3 + 2HCl→CaCl2 + N2 O + CO2
Aufgabe 2 Platzieren Sie die Koeffizienten in den Gleichungen chemischer Reaktionen (beachten Sie, dass der Koeffizient die Anzahl der Atome nur eines Elements ändert).):
1. Fe 2 Ö 3 + A l → A l 2 UM 3 + Fe; Mg+N 2 → Mg 3 N 2 ;
2.Al+S → Al 2 S 3 ; A1+ MIT → Al 4 C 3 ;
3. Al + Cr 2 Ö 3 → Cr+Al 2 Ö 3 ; Ca+P → Ca 3 P 2 ;
4. C + H 2 → CH 4 ; Ca + C → SaS 2 ;
5. Fe + O 2 → Fe 3 Ö 4 ; Si + Mg → Mg 2 Si;
6/.Na+S → N / A 2 S; CaO+ MIT → CaC 2 + CO;
7.Ca+N 2 → C A 3 N 2 ; Si+Cl 2 → SiCl 4 ;
8. Ag+S → Ag 2 S; N 2 + MIT l 2 → NS l;
9.N 2 + O 2 → NEIN; CO 2 + MIT → CO ;
10. HALLO → N 2 → + 1 2 ; Mg+ NS l → MgCl 2 + N 2 ;
11.FeS+ NS 1 → FeCl 2 +H 2 S; Zn+HCl → ZnCl 2 +H 2 ;
12. Br 2 +KI → KBr+ I 2 ; Si+HF (R) → SiF 4 +H 2 ;
1./ HCl+Na 2 CO 3 → CO 2 +H 2 O+ NaCl; KClO 3 +S → → KCl+SO 2 ;
14. Kl 2 + KBr → KCl + Br 2 ; SiO 2 + MIT → Si + CO;
15. SiO 2 + MIT → SiC + CO; Mg + SiO 2 → Mg 2 Si + MgO
16. Mg 2 Si + HCl → MgCl 2 + SiH 4
1.Wie lautet die Gleichung einer chemischen Reaktion?
2.Was steht auf der rechten Seite der Gleichung? Und links?
3.Was bedeutet das „+“-Zeichen in einer Gleichung?
4. Warum werden Koeffizienten in chemische Gleichungen eingesetzt?
Um herauszufinden, wie man eine chemische Gleichung ausgleicht, müssen Sie zunächst den Zweck dieser Wissenschaft kennen.
Definition
Die Chemie untersucht Stoffe, ihre Eigenschaften und Umwandlungen. Wenn es zu keiner Farbveränderung, Ausfällung oder Freisetzung einer gasförmigen Substanz kommt, findet keine chemische Wechselwirkung statt.
Beim Feilen eines Eisennagels verwandelt sich das Metall beispielsweise einfach in Pulver. In diesem Fall findet keine chemische Reaktion statt.
Die Kalzinierung von Kaliumpermanganat geht mit der Bildung von Manganoxid (4) einher, es wird Sauerstoff freigesetzt, d. h. es wird eine Wechselwirkung beobachtet. In diesem Fall stellt sich ganz natürlich die Frage, wie man chemische Gleichungen richtig ausgleicht. Schauen wir uns alle Nuancen an, die mit einem solchen Verfahren verbunden sind.

Besonderheiten chemischer Umwandlungen
Zu den chemischen Umwandlungen zählen alle Phänomene, die mit einer Veränderung der qualitativen und quantitativen Zusammensetzung von Stoffen einhergehen. In molekularer Form kann der Prozess der Eisenverbrennung in der Atmosphäre durch Zeichen und Symbole ausgedrückt werden.
Methodik zur Festlegung von Koeffizienten
Wie gleicht man Koeffizienten in chemischen Gleichungen aus? Der Chemiekurs der Oberstufe behandelt die Methode der elektronischen Waage. Schauen wir uns den Prozess genauer an. Zunächst ist es bei der ersten Reaktion notwendig, die Oxidationsstufen jedes chemischen Elements festzulegen.
Es gibt bestimmte Regeln, nach denen sie für jedes Element bestimmt werden können. In einfachen Stoffen sind die Oxidationsstufen Null. In binären Verbindungen hat das erste Element einen positiven Wert, der der höchsten Wertigkeit entspricht. Bei letzterem wird dieser Parameter durch Subtraktion der Gruppennummer von acht ermittelt und hat ein Minuszeichen. Formeln, die aus drei Elementen bestehen, haben ihre eigenen Nuancen bei der Berechnung der Oxidationsstufen.
Für das erste und letzte Element ist die Reihenfolge ähnlich wie bei binären Verbindungen und es wird eine Gleichung zur Berechnung des zentralen Elements aufgestellt. Die Summe aller Indikatoren muss gleich Null sein, daraus wird der Indikator für das mittlere Element der Formel berechnet.
Lassen Sie uns das Gespräch darüber fortsetzen, wie man chemische Gleichungen mithilfe der Methode der elektronischen Waage ausgleicht. Nachdem die Oxidationsstufen ermittelt wurden, ist es möglich, diejenigen Ionen oder Stoffe zu bestimmen, die bei chemischer Wechselwirkung ihren Wert geändert haben.
Die Plus- und Minuszeichen müssen die Anzahl der Elektronen angeben, die während der chemischen Wechselwirkung aufgenommen (abgegeben) wurden. Zwischen den resultierenden Zahlen wird das kleinste gemeinsame Vielfache gefunden.
Durch Aufteilung in empfangene und abgegebene Elektronen erhält man die Koeffizienten. Wie balanciert man eine chemische Gleichung? Die in der Bilanz ermittelten Zahlen müssen den entsprechenden Formeln vorangestellt werden. Voraussetzung ist die Überprüfung der Menge jedes Elements auf der linken und rechten Seite. Wenn die Koeffizienten richtig platziert sind, sollte ihre Anzahl gleich sein.

Gesetz der Massenerhaltung von Stoffen
Bei der Diskussion darüber, wie man eine chemische Gleichung ausgleicht, muss dieses Gesetz verwendet werden. Wenn man bedenkt, dass die Masse der Stoffe, die eine chemische Reaktion eingegangen sind, gleich der Masse der resultierenden Produkte ist, wird es möglich, den Formeln Koeffizienten voranzustellen. Wie lässt sich beispielsweise eine chemische Gleichung ausgleichen, wenn die einfachen Substanzen Kalzium und Sauerstoff interagieren und nach Abschluss des Prozesses ein Oxid entsteht?
Um die Aufgabe zu bewältigen, muss berücksichtigt werden, dass Sauerstoff ein zweiatomiges Molekül mit einer kovalenten unpolaren Bindung ist. Daher lautet seine Formel wie folgt: O2. Auf der rechten Seite wird bei der Zusammensetzung von Calciumoxid (CaO) die Wertigkeit jedes Elements berücksichtigt.
Zuerst müssen Sie die Sauerstoffmenge auf jeder Seite der Gleichung überprüfen, da sie unterschiedlich ist. Nach dem Massenerhaltungssatz von Stoffen muss der Produktformel ein Koeffizient von 2 vorangestellt werden. Als nächstes wird Kalzium überprüft. Damit es ausgeglichen wird, setzen wir einen Koeffizienten von 2 vor die ursprüngliche Substanz. Als Ergebnis erhalten wir den Eintrag:
- 2Ca+O2=2CaO.

Analyse der Reaktion mit der Methode der elektronischen Waage
Wie balanciert man chemische Gleichungen? Beispiele für OVR helfen bei der Beantwortung dieser Frage. Nehmen wir an, dass es notwendig ist, die Koeffizienten im vorgeschlagenen Schema nach der Methode der elektronischen Waage anzuordnen:
- CuO + H2=Cu + H2O.
Zunächst werden wir den einzelnen Elementen in den Ausgangsstoffen und Reaktionsprodukten Oxidationsstufen zuordnen. Wir erhalten die folgende Form der Gleichung:
- Cu(+2)O(-2)+H2(0)=Cu(0)+H2(+)O(-2).
Für Kupfer und Wasserstoff haben sich die Indikatoren geändert. Auf dieser Grundlage erstellen wir eine elektronische Bilanz:
- Cu(+2)+2е=Cu(0) 1 Reduktionsmittel, Oxidation;
- H2(0)-2e=2H(+) 1 Oxidationsmittel, Reduktion.
Basierend auf den in der elektronischen Waage erhaltenen Koeffizienten erhalten wir den folgenden Eintrag für die vorgeschlagene chemische Gleichung:
- CuO+H2=Cu+H2O.
Nehmen wir ein weiteres Beispiel, bei dem Koeffizienten festgelegt werden:
- H2+O2=H2O.
Um dieses auf dem Stofferhaltungssatz basierende Schema auszugleichen, ist es notwendig, mit Sauerstoff zu beginnen. Da ein zweiatomiges Molekül reagiert hat, muss der Formel des Reaktionsprodukts ein Koeffizient von 2 vorangestellt werden.
- 2H2+O2=2H2O.

Abschluss
Basierend auf der elektronischen Waage können Sie Koeffizienten in beliebige chemische Gleichungen einfügen. Absolventen der neunten und elften Klassen von Bildungseinrichtungen, die sich für eine Prüfung in Chemie entscheiden, werden in einer der Aufgaben der Abschlussprüfung ähnliche Aufgaben angeboten.











