Митохондрии в каких клетках встречаются. Митохондрии: строение и функции. Появление термина и место в теории симбиогенеза
Митохондрии (МТ) – одно из самых интересных мне направлений исследований. Объединение митохондрий с другой клеткой в ходе эндосимбиоза около 1,6 млрд лет назад стало основной всех многоклеточных эукариотов со сложной структурой. Предположительно митохондрии произошли от клеток, напоминающих α-протеобактерии.
Лучшее обзорное исследование последнего времени по митохондриях – работа Вернера Кулбрандта «Структура и функция митохондриальных белковых комплексов мембраны ». Если вы знаете английский язык и интересуетесь устройством этих органелл, то настоятельно рекомендую к прочтению. Эта статья так хороша, что может быть смело главой хорошего учебника по молекулярной биологии. Сначала я хотел перевести всю статью, но это бы заняло непростительно много времени и оторвало бы от других дел. Поэтому ограничусь тезисами и картинками. Периодически разбавляя все своими мыслями.
Митохондрия кодирует сама только 13 белков, не смотря на наличие отдельной от клетки ДНК (мтДНК) и всего «производственного» цикла по транскрипции белков. Изолированная митохондрия какое-то время может сохранять композицию и функционировать.
Рисунок 1. Компоненты мембраны митохондриона. Внешняя мембрана отделяет митохондрию от цитоплазмы. Она окружает внутреннюю мембрану, которая отделяет межмембранное пространство от богатого белками центрального матрикса. Внутреннюю мембрану разделяют на внутреннюю пограничную мембрану и кристы. Две эти части непрерывны в местах крепления крист (cristae junction ). Кристы простираются более или менее глубоко в матрикс и являются основным место митохондриального преобразования энергии. Небольшой протоновый градиент в межмембранном пространстве (pH 7,2-7,4) и матрикс (pH 7,9-8,0) приводят к образованию АТФ АТФ-синтазой в мембранах крист.
Внешняя мембрана пористая и позволяет веществам из цитоплазмы проходить через нее. Внутренняя мембрана плотная, для ее пересечения нужны транспортные белки [Гилберт Линг обоснованно не согласен], непрерывность барьера позволяет иметь внутренней мембране электрохимический потенциал в -180 mV. У матрикса довольно большой pH (7,9-8). Еще раз углублюсь в Линга. Щелочной (выше 7) pH способствует более развернутой конформации белков . Высокий pH нарушает водородные и солевые связи, делая поляризованные CO и NH доступными молекулам воды, там самым усиливая дипольный момент всей внутриклеточной воды и связывая ее. В этом ключе наличие мембраны нужно не для «удержания» протоплазмы внутри клетки (это делают сами белки при высоком pH), а для наличия потенциала.
мтДНК находится в нуклеотидах, которых примерно 1000 на клетку. Белковая плотность матрикса довольна высокая (до 500 мг/мл), что близко к кристаллизованным белкам.
Внутренняя мембрана образует инвагинации, называемые кристами, которые глубоко проникают в матрикс. Кристы определяют третий «отсек» митохондрий – просвет крист (cristae lumen). Мембраны кристы содержат большинство, если не все, полностью «собранные» комплексы цепи переноса электронов и АТФ-синтазы. Просвет кристы содержит большое количество маленького растворимого белкового переносчика электронов (цитохром с). Митохондриальные кристы, таким образом, основное место биологической конверсии энергии во всех не фотосинтетических эукариотах.
С кристами тоже много всего интересного. Оптические свойства кристы влияют на распространение и генерацию света в тканях. Я даже встречал идеи о том, что поверхность крист подобна (предположение) поверхностям топологических изоляторов (подразумевалась суперпроводимость без диссипации заряда).
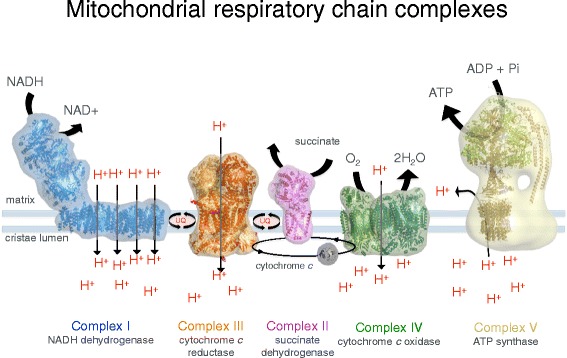
Рисунок 2. Мембранные белковые комплексы дыхательной цепи. Комплекс I (NADH / убихинон оксидоредуктаза, синий), Комплекс II (сукцинат дегидрогеназа, розовы), Комплекс III (цитохром С редуктаза, оранжевый), Комплекс IV (цитохром С оксидаза, зеленый) и митохондриальная АТФ синтаза (известная как комплекс V , бежевая) работают вместе во время окислительного фосфорилирования, чтобы клетки могли использовать энергию. Комплексы I , III , IV выкачивают протоны вдоль мембраны кристы, создавая протоновый градиент, стимулирующий синтез АТФ.
Теперь немного внимания на комплекс II. Вы помните, что жир (кето) делает упор в метаболизме на FADH2 и комплекс II. Они восстанавливают пару CoQ, в какой-то момент окисленного CoQ не хватает для транспортировки электронов на комплекс III и образует обратный поток электронов на комплекс I с образованием супероксида. При долгом HFLC-питании комплекс I будет обратимо разрушен, при этом это нормальная физиологическая оптимизация.
Еще прошу вас заметить, что комплекс II не выкачивает протоны. Что у нас рассеивает протоновый градиент, нарушает фосфорилирование и стимулирует сжигание жиров на тепло? Правильно, стресс холода. Термогенез связан с метаболизмом через комплекс, который не выкачивает протоны, тем самым не давая дополнительных протонов для АТФ-синтазы. Можно только удивляться как замечательно у нас продуман организм.
Крепления крист и MICOS
Места крепления крист (cristae junctions) – маленькие круглы отверстия примерно 25 нм диаметром. В митохондриях всех организмов есть система MICOS (mitochondria contact site and cristae to outer membrane), сборка из пяти мембранных и одного растворимого белков, прикрепляющих кристы к наружной мембране.
В клетках с повышенной потребностью в энергии, такие как скелетные и сердечные мышцы, кристы плотно заполняют большую часть объема митохондрии. В тканях с меньшими потребностями в энергии, таких как печень и почки, кристы находятся не так плотно по отношению друг к другу. Остается больше места в матрице для биосинтетических ферментов.

Рисунок 3. Томографический объем митохондрии сердца мыши. А) Трехмерный объем митохондрии сердца мыши, снятый cryo-ET. Наружная мембрана (серая) окутывает внутреннюю мембрану (светло-синяя). Внутренняя мембрана плотно наполнена кристами б) Томографический срез объема. Плотно заполненный матрикс, содержащий большую часть митохондриальных белков, выглядит темным на электронном микроскопе. В то время как межмембранное пространство и просветы крист выглядят светлыми из-за низкой концентрации белков.
Димеры АТФ синтазы
Митохондриальная F1-F0 АТФ синтаза является самым заметным белковым комплексом кристы. АТФ синтаза – это древняя наномашина, которая использует электрохимический протновых градиент вокруг внутренней мембраны для создания АФТ посредством вращательного катализа . Протоны, двигающиеся через F0 комплекс мембраны, вращают ротор из 8 (у млекопитающих) или 10 (у дрожжей) с-узлов. Центральный стебель передает крутящий момент c-ротора каталитической головке F1, где АТФ образуется из АДФ и фосфата через последовательность конформационных изменения. Периферийный стебель предотвращает непродуктивное вращение Головы F1 против комплекса F0.
Многие годы считалось, что АТФ синтаза случайным образом располагается на внутренней мембране. Но оказалось, что АТФ синтаза располагается двойными рядами . Причем линейные ряды АТФ синтазы – фундаментальный атрибут всех живых митохондрий.

Рисунок 4. Двойные ряды АТФ синтазы у семи разных видов.
Ряды АТФ синтазы располагаются в основном вдоль хребтов крист. Димеры изгибают липидный бислой и как следствие само-организуются в ряды. Когда у митохондрий дрожжей выбивали узлы e и g АФТ синтазы, то штамм рос на 60% медленней диких собратьев, и потенциал мембран их митохондрий был снижен вдвое. У АФТ синтазы прокариотов недостает нескольких узлов, связанных с димерами, ряды димеров не были найдены у бактерий и архей. Кристы и ряды димеров АФТ синтазы, таким образом, являются адаптацией к большим энергетическим потребностям организма.

Рисунок 5. Структура димера АТФ синтазы митохондрии polymella sp. Вид сбоку на V-образный димер АТФ синтазы.
Комплексы и суперкомплексы дыхательной цепи
Протоновый градиент вокруг внутренней мембраны создается тремя крупными мембранными комплексами, известными как комплекс I, комплекс III и комплекс IV (см. рисунок 2). Комплекс I кормится электронами из NADH, высвобождаемая при передаче электрона энергия выкачивает четыре протона. Комплекс III получает электрон от восстановленного хинола и передает его носителю электронов (цитохрому с), выкачивая в процессе один протон. Комплекс IV получает электрон из цитохрома с и передает его молекулярному кислороду, выкачивая 4 протона за каждую молекулу кислорода, превращенную в воду. Комплекс II не выкачивает протоны, напрямую передавая электроны хинолу. Как перенос электронов из NADH в хинол связан с транслокацией протонов пока не ясно. Комплекс I – крупнее III и IV вместе взятых.

Рисунок 6. Комплекс I митохондрии коровьего сердца. Матриксная часть содержит ряд из восьми железно-серных (Fe-S) кластеров, которые направляют электроны из NADH в хинол на пересечении матрикса и мембраны. Мембранная часть состоит из 78 лопастей, включая выкачивающие протоны молекулы.
Комплексы I, III и IV соединяются в суперкомплексы или респирасомы. У пекарских дрожжей (saccharomyces cerevisiae ) нет комплекса I, их суперкомплексы состоят из III и IV. Роль суперкомплексов пока еще не ясна. Предполагают, что это делает транспорт электронов более эффективным, но прямых доказательств этому пока нет.

Рисунок 7. Суперкомплекс митохондрии коровьего сердца. Обратите внимание на дистанцию между комплексами I и III, который надо проделать хинолу. Стрелки – движения электрона в суперкомплексе.
Основным белком просвета кристы является цитохром с, который переносит электрон из комплекса III в комплекс IV. Если цитохром с высвобождается в цитоплазму клетки, то вызывает апоптоз .

Рисунок 8. Ряды димеров АТФ синтазы задают форму кристам. У хребта кристы АФТ синтаза (желтый) образует слив для протонов (красный), протоновые насосы электронной цепи (зеленый) находятся по обоим сторона рядов димеров. Направляя протоны от источника к АТФ синтазе, кристы работают как протоновые направляющие, позволяющие эффективное производство АТФ. Красные стрелки показывают направление потока протонов.
Реорганизация мембраны во время старения
Старение – фундаментальный и плохо понимаемый процесс всех эукариотов. Исследовали старение митохондрий на грибах Podospora anserina , которые живут всего 18 дней. В нормальной митохондрии кристы проникают глубоко в матрикс. Для этого нужны ряды димеров АТФ синтазы и MICOS комплекс у мест крепления крист. С возрастом кристы начинают все ближе подходить к поверхности мембраны, димеры АФТ синтазы превщаются в мономеры, и все заканчивается высвобождением цитохрома с и клеточной смертью.
Транспорт электронов создает супероксид в комплексах I и III. Это побочный продукт метаболизма. Одновременно необходимый и смертельно опасный. Во время старения деление (fission) начинает превалировать над сращением (fussion). Это не дает поврежденным митохондриям «спастись» путем сращения и ускоряет неизбежное.

Рисунок 9. Изменения морфологии внутренней мембраны и димеров АТФ синтазы во время старения митохондрии.
Как видите, полей для будущих исследований очень много. Я предполагаю стык физики и биологии, где физики будут пытаются объяснить почему такая структура более энергетически эффективна. Тем более публикации по квантовой биологии
Происхождение митохондрий
Межмембранное пространство
Межмембранное пространство представляет собой пространство между наружной и внутренней мембранами митохондрии. Его толщина - 10-20 нм. Так как наружная мембрана митохондрии проницаема для небольших молекул и ионов, их концентрация в периплазматическом пространстве мало отличается от таковой в цитоплазме. Напротив, крупным белкам для транспорта из цитоплазмы в периплазматическое пространство необходимо иметь специфические сигнальные пептиды; поэтому белковые компоненты периплазматического пространства и цитоплазмы различны. Одним из белков, содержащихся в периплазматическом пространстве, является цитохром c - один из компонентов дыхательной цепи митохондрий.
Внутренняя мембрана
Внутренняя мембрана образует многочисленные гребневидные складки - кристы, существенно увеличивающие площадь ее поверхности и, например, в клетках печени составляет около трети всех клеточных мембран. Характерной чертой состава внутренней мембраны митохондрий является присутствие в ней кардиолипина - особого фосфолипида , содержащего сразу четыре жирные кислоты и делающего мембрану абсолютно непроницаемой для протонов . Ещё одна особенность внутренней мембраны митохондрий - очень высокое содержание белков (до 70 % по весу), представленных транспортными белками , ферментами дыхательной цепи , а также крупными АТФ-синтетазными комплексами. Внутренняя мембрана митохондрии в отличие от внешней не имеет специальных отверстий для транспорта мелких молекул и ионов; на ней, на стороне, обращенной к матриксу, располагаются особые молекулы АТФ-синтазы , состоящие из головки, ножки и основания. При прохождении через них протонов происходит синтез АТФ . В основании частиц, заполняя собой всю толщу мембраны, располагаются компоненты дыхательной цепи . Наружная и внутренняя мембраны в некоторых местах соприкасаются, там находится специальный белок-рецептор, способствующий транспорту митохондриальных белков, закодированных в ядре, в матрикс митохондрии.
Матрикс
Матрикс - ограниченное внутренней мембраной пространство. В матриксе (розовом веществе) митохондрии находятся ферментные системы окисления пирувата , жирных кислот, а также ферменты цикла трикарбоновых кислот (цикла Кребса). Кроме того, здесь же находится митохондриальная ДНК , РНК и собственный белоксинтезирующий аппарат митохондрии.
Митохондриальная ДНК
Находящаяся в матриксе митохондриальная ДНК представляет собой замкнутую кольцевую двуспиральную молекулу , в клетках человека имеющую размер 16569 нуклеотидных пар, что приблизительно в 10 5 раз меньше ДНК, локализованной в ядре . В целом митохондриальная ДНК кодирует 2 рРНК , 22 тРНК и 13 субъединиц ферментов дыхательной цепи , что составляет не более половины обнаруживаемых в ней белков . В частности, под контролем митохондрального генома кодируются семь субъединиц АТФ-синтетазы, три субъединицы цитохромоксидазы и одна субъединица убихинол-цитохром-с -редуктазы. При этом все белки, кроме одного, две рибосомные и шесть тРНК транскрибируются с более тяжёлой (наружной) цепи ДНК, а 14 других тРНК и один белок транскрибируются с более лёгкой (внутренней) цепи.
На этом фоне геном митохондрий растений значительно больше и может достигать 370000 нуклеотидных пар, что примерно в 20 раз больше описанного выше генома митохондрий человека. Количество генов здесь также примерно в 7 раз больше, что сопровождается появлением в митохондриях растений дополнительных путей электронного транспорта, не сопряжённых с синтезом АТФ.
Таким образом, суммарная реакция, катализируемая ферментами дыхательной цепи, состоит в окислении НАДН кислородом с образованием воды. По сути этот процесс заключается в ступенчатом переносе электронов между атомами металлов , присутствующих в простетических группах белковых комплексов дыхательной цепи, где каждый последующий комплекс обладает более высоким сродством к электрону, чем предыдущий. При этом сами электроны передаются по цепи до тех пор, пока не соединятся с молекулярным кислородом, обладающим наибольшим сродством к электронам. Освобождаемая же при этом энергия запасается в виде электрохимического (протонного) градиента по обе стороны внутренней мембраны митохондрий. При этом считается, что в процессе транспорта по дыхательной цепи пары электронов перекачивается от трёх до шести протонов.
Завершающим этапом функционирования митохондрии является генерация АТФ , осуществляемая встроенным во внутреннюю мембрану специальным макромолекулярным комплексом с молекулярной массой 500 кДа. Этот комплекс, называемый АТФ-синтетазой, как раз и катализирует синтез АТФ путём конверсии энергии трансмембранного электрохимического градиента протонов водорода в энергию макроэргической связи молекулы АТФ.
АТФ-синтеза
В структурно-функциональном плане АТФ-синтаза состоит из двух крупных фрагментов, обозначаемых символами F 1 и F 0 . Первый из них (фактор сопряжения F 1) обращён в сторону матрикса митохондрии и заметно выступает из мембраны в виде сферического образования высотой 8 нм и шириной 10 нм. Он состоит из девяти субъединиц, представленных пятью типами белков. Полипептидные цепи трёх субъединиц α и стольких же субъединиц β уложены в похожие по строению белковые глобулы , которые вместе образуют гексамер (αβ) 3 , имеющий вид слегка приплюснутого шара. Подобно плотно уложенным долькам апельсина, последовательно расположенные субъединицы α и β образуют структуру, характеризующуюся осью симметрии третьего порядка с углом поворота 120°. В центре этого гексамера находится субъединица γ, которая образована двумя протяжёнными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. При этом нижняя часть субъединицы γ выступает из шара на 3 нм в сторону мембранного комплекса F 0 . Также внутри гексамера находится минорная субъединица ε, связанная с γ. Последняя (девятая) субъединица обозначается символом δ и расположена на внешней стороне F 1 .
Мембранная часть АТФ-синтазы, называемая фактором сопряжения F 0 , представляет собой гидрофобный белковый комплекс, пронизывающий мембрану насквозь и имеющий внутри себя два полуканала для прохождения протонов водорода. Всего в состав комплекса F 0 входит одна белковая субъединица типа а , две копии субъединицы b , а также от 9 до 12 копий мелкой субъединицы c . Субъединица а (молекулярная масса 20 кДа) полностью погружена в мембрану, где образует шесть пересекающих её α-спиральных участков. Субъединица b (молекулярная масса 30 кДа) содержит лишь один сравнительно короткий погружённый в мембрану α-спиральный участок, а остальная её часть заметно выступает из мембраны в сторону F 1 и закрепляется за расположенную на её поверхности субъединицу δ. Каждая из 9-12 копий субъединицы c (молекулярная масса 6-11 кДа) представляет собой сравнительно небольшой белок из двух гидрофобных α-спиралей, соединённых друг с другом короткой гидрофильной петлёй, ориентированной в сторону F 1 , а все вместе образуют единый ансамбль, имеющий форму погружённого в мембрану цилиндра. Выступающая из комплекса F 1 в сторону F 0 субъединица γ как раз и погружена внутрь этого цилиндра и достаточно прочно зацеплена за него.
Таким образом, в молекуле АТФ-синтазы можно выделить две группы белковых субъединиц, которые могут быть уподоблены двум деталям мотора: ротору и статору . «Статор» неподвижен относительно мембраны и включает в себя шарообразный гексамер (αβ) 3 , находящуюся на его поверхности и субъединицу δ, а также субъединицы a и b мембранного комплекса F 0 . Подвижный относительно этой конструкции «ротор» состоит из субъединиц γ и ε, которые, заметно выступая из комплекса (αβ) 3 , соединяются с погружённым в мембрану кольцом из субъединиц c .
Способность синтезировать АТФ - свойство единого комплекса F 0 F 1 , сопряжённого с переносом протонов водорода через F 0 к F 1 , в последнем из которых как раз и расположены каталитические центры, осуществляющие преобразование АДФ и фосфата в молекулу АТФ. Движущей же силой для работы АТФ-синтазы является протонный потенциал, создаваемый на внутренней мембране митохондрий в результате работы цепи электронного транспорта.
Сила, приводящая в движение «ротор» АТФ-синтазы, возникает при достижении разности потенциалов между наружной и внутренней сторонами мембраны > 220 мВ и обеспечивается потоком протонов, протекающих через специальный канал в F 0 , расположенный на границе между субъединицами a и c . При этом путь переноса протонов включает в себя следующие структурные элементы:
- Два расположенных несоосно «полуканала», первый из которых обеспечивает поступление протонов из межмембранного пространства к существенно важным функциональным группам F 0 , а другой обеспечивает их выход в матрикс митохондрии;
- Кольцо из субъединиц c , каждая из которых в своей центральной части содержит протонируемую карбоксильную группу, способную присоединять H + из межмембранного пространства и отдавать их через соответствующие протонные каналы. В результате периодических смещений субъединиц с , обусловленных потоком протонов через протонный канал происходит поворот субъединицы γ, погружённой в кольцо из субъединиц с .
Таким образом, каталитическая активность АТФ-синтазы непосредственно связана с вращением её «ротора», при котором поворот субъединицы γ вызывает одновременное изменение конформации всех трёх каталитических субъединиц β, что в конечном счёте и обеспечивает работу фермента. При этом в случае образования АТФ «ротор» крутится по часовой стрелке со скоростью четыре оборота в секунду, а само подобное вращение происходит дискретными скачками по 120°, каждый из которых сопровождается образованием одной молекулы АТФ.
Непосредственная функция синтеза АТФ локализована на β-субъединицах сопрягающего комплекса F 1 . При этом самым первым актом в цепи событий, приводящих к образованию АТФ, является связывание АДФ и фосфата с активным центром свободной β-субъединицы, находящейся в состоянии 1. За счёт энергии внешнего источника (тока протонов) в комплексе F 1 происходят конформационные изменения, в результате которых АДФ и фосфат становятся прочно связанными с каталитическим центром (состояние 2), где становится возможным образование ковалентной связи между ними, ведущей к образованию АТФ. На данной стадии АТФ-синтазы ферменту практически не требуется энергии, которая будет необходима на следующем этапе для освобождения прочно связанной молекулы АТФ из ферментативного центра. Поэтому следующий этап работы фермента заключается в том, чтобы в результате энергозависимого структурного изменения комплекса F 1 каталитическая β-субъединица, содержащая прочно связанную молекулу АТФ, перешла в состояние 3, в котором связь АТФ с каталитическим центром ослаблена. В результате этого молекула АТФ покидает фермент, а β-субъединица возвращается в исходное состояние 1, благодаря чему обеспечивается цикличность работы фермента.
Работа АТФ-синтазы связана с механическими движениями её отдельных частей, что позволило отнести этот процесс к особому типу явлений, названных «вращательным катализом». Подобно тому, как электрический ток в обмотке электродвигателя приводит в движение ротор относительно статора, направленный перенос протонов через АТФ-синтетазу вызывает вращение отдельных субъединиц фактора сопряжения F 1 относительно других субъединиц ферментного комплекса, в результате чего это уникальное энергообразующее устройство совершает химическую работу - синтезирует молекулы АТФ. В дальнейшем АТФ поступает в цитоплазму клетки, где расходуется на самые разнообразные энергозависимые процессы. Подобный перенос осуществляется специальным встроенным в мембрану митохондрий ферментом АТФ/АДФ-транслоказой, который обменивает вновь синтезированную АТФ на цитоплазматическую АДФ, что гарантирует сохранность фонда адениловых нуклеотидов внутри митохондрий.
Словарь синонимов
Митохондрия. См. пластосома. (
Двумембранная органелла - митохондрия - характерна для клеток эукариот. От функций митохондрий зависит работа организма в целом.
Строение
Митохондрии состоят из трёх взаимосвязанных компонентов:
- наружной мембраны;
- внутренней мембраны;
- матрикса.
Внешняя гладкая мембрана состоит из липидов, между которых находятся гидрофильные белки, образующие канальцы. Сквозь эти канальцы проходят молекулы при транспорте веществ.
Наружная и внутренняя мембраны находятся на расстоянии 10-20 нм. Межмембранное пространство заполнено ферментами. В отличие от ферментов лизосом, участвующих в расщеплении веществ, ферменты межмембранного пространства переносят остатки фосфорной кислоты к субстрату с затратой АТФ (процесс фосфорилирования).
Внутренняя мембрана упакована под внешней мембраной в виде многочисленных складок - крист.
Они образованы:
- липидами, проницаемыми только для кислорода, углекислого газа, воды;
- ферментными, транспортными белками, участвующими в окислительных процессах и транспорте веществ.
Здесь за счёт дыхательной цепи происходит вторая стадия клеточного дыхания и образование 36 молекул АТФ.
ТОП-4 статьи которые читают вместе с этой
Между складками находится полужидкое вещество - матрикс.
В состав матрикса входят:
- ферменты (сотни разных видов);
- жирные кислоты;
- белки (67 % белков митохондрий);
- митохондриальная кольцевая ДНК;
- митохондриальные рибосомы.
Наличие рибосом и ДНК свидетельствует о некоторой автономности органоида.

Рис. 1. Строение митохондрий.
Ферментативные белки матрикса участвуют в окислении пирувата - пировиноградной кислоты в ходе клеточного дыхания.
Значение
Основная функция митохондрий в клетке - синтез АТФ, т.е. генерация энергии. В результате клеточного дыхания (окисления) образуется 38 молекул АТФ. Синтез АТФ происходит на основе окисления органических соединений (субстрата) и фосфорилирования АДФ. Субстратом для митохондрий являются жирные кислоты и пируват.

Рис. 2. Образование пирувата в результате гликолиза.
Общее описание процесса дыхания представлено в таблице.
|
Где происходит |
Вещества |
Процессы |
|
Цитоплазма |
В результате гликолиза разлагается на две молекулы пировиноградной кислоты, которые поступают в матрикс |
|
|
Отщепляется ацетильная группа, которая присоединяется к коферменту А (КоА), образуя ацетил-кофермент-А (ацетил-КоА), и выделяется молекула углекислого газа. Ацетил-КоА также может формироваться из жирных кислот в отсутствии синтеза углеводов |
||
|
Ацетил-КоА |
Вступает в цикл Кребса или цикл лимонной кислоты (цикл трикарбоновых кислот). Начинается цикл с образования лимонной кислоты. Далее в результате семи реакций образуется две молекулы углекислого газа, НАДН и ФАДН2 |
|
|
НАДН и ФАДН2 |
Окисляясь, НАДН разлагается на НАД + , два высокоэнергетических электрона (е –) и два протона Н + . Электроны передаются в дыхательную цепь, содержащую три ферментных комплекса, на внутренней мембране. Прохождение электрона по комплексам сопровождается выделением энергии. Одновременно протоны высвобождаются в межмембранное пространство. Свободные протоны стремятся вернуться в матрикс, что создаёт электрический потенциал. При нарастании напряжения Н + устремляются внутрь через АТФ-синтазу - специальный белок. Энергия протонов используется для фосфорилирования АДФ и синтеза АТФ. Соединяясь с кислородом, Н + образует воду |

Рис. 3. Процесс клеточного дыхания.
Митохондрии - органеллы, от которых зависит работа целого организма. Признаками нарушения функций митохондрий являются снижение скорости потребления кислорода, увеличение проницаемости внутренней мембраны, набухание митохондрии. Эти изменения происходят вследствие токсического отравления, инфекционного заболевания, гипоксии. 4.5 . Всего получено оценок: 74.
Митохондрии есть у всех типов эукариотных клеток (рис. 1). Они имеют вид либо округлых телец, либо палочек, реже - нитей. Их размеры колеблются от 1 до 7 мкм. Число митохондрий в клетке составляет от нескольких сотен до десятков тысяч (у крупных простейших).
Рис . 1. Митохондрии. Вверху - митохондрии (?) в мочевых канальцах, видимые в световом микроскопе. Внизу - трехмерная модель организации митохондрии: 1 - кристы; 2 - внешняя мембрана; 3 - внутренняя мембрана; 4 - матрикс
Митохондрия образована двумя мембранами - внешней и внутренней , между которыми расположено межмембранное пространство . Внутренняя мембрана образует множество впячиваний - крист, представляющих собой либо пластины, либо трубочки. Такая ее организация обеспечивает огромную площадь внутренней мембраны. На ней располагаются ферменты, обеспечивающие преобразование энергии, заключенной в органических веществах (углеводах, липидах), в энергию АТФ, необходимую для жизнедеятельности клетки. Следовательно, функция митохондрий - участие в энергетических клеточных процессах. Именно поэтому большое количество митохондрий присуще, например, мышечным клеткам, выполняющим большую работу.
Пластиды . В растительных клетках обнаруживаются особые органоиды - пластиды, имеющие чаще веретеновидную или округлую форму, иногда более сложную. Различают три вида пластид - хлоропласты (рис. 2), хромопласты и лейкопласты.
Хлоропласты отличаются зеленым цветом, который обусловлен пигментом - хлорофиллом , обеспечивающим процесс фотосинтеза , т. е. синтеза органических веществ из воды (Н 2 О) и углекислого газа (СО 2) с использованием энергии солнечного света. Хлоропласты содержатся преимущественно в клетках листьев (у высших растений). Они сформированы двумя параллельно расположенными друг другу мембранами, окружающими содержимое хлоропластов - строму . Внутренняя мембрана образует многочисленные уплощенные мешочки - тилакоиды , которые сложены в стопки (наподобие стопки монет) - граны - и лежат в строме. Именно в тила-коидах и содержится хлорофилл.
Хромопласты определяют желтый, оранжевый и красный цвет многих цветков и плодов, в клетках которых присутствуют в большом количестве. Основными пигментами в их составе являются каротины . Функциональное назначение хромопластов состоит в цветовом привлечении животных, обеспечивающих опыление цветков и распространение семян.

Рис. 2. Пластиды: а - хлоропласты в клетках листа элодеи, видимые в световом микроскопе; б - схема внутреннего строения хлоропласта с гранами, представляющими собой стопки плоских мешочков, расположенных перпендикулярно поверхности хлоропласта; в - более подробная схема, на которой видны анастомозирующие трубочки, соединяющие отдельные камеры гран
Лейкопласты - это бесцветные пластиды, содержащиеся в клетках подземных частей растений (например, в клубнях картофеля), семян и сердцевины стеблей. В лейкопластах, главным образом, происходит образование из глюкозы крахмала и накапливание его в запасающих органах растений.
Пластиды одного вида могут превращаться в другой. Например, при осеннем изменении цвета листьев хлоропласты превращаются в хромопласты.
Митохондрии
Митохондрии - это структуры палочковидной или овальной формы (греч. mitos - нить, chondros - гранула). Они обнаружены во всех животных клетках (исключая зрелые эритроциты): у высших растений, у водорослей и простейших. Отсутствуют они только у прокариот бактерий.
Эти органеллы впервые были обнаружены и описаны в конце прошлого столетия Альтманом. Несколько позже эти структуры были названы митохондриями. В 1948 г. Хогебум указал на значение митохондрий как центра клеточного дыхания, а в 1949 г. Кеннеди и Ленинджер установили, что в митохондриях протекает цикл окислительного фосфорилирования. Так было доказано, что митохондрии служат местом генерирования энергии.
Митохондрии видны в обычном световом микроскопе при специальных методах окраски. В фазово - контрастном микроскопе и в «темном поле» их можно наблюдать в живых клетках.
Строение, размеры, форма митохондрий очень вариабельны. Это зависит в первую очередь от функционального состояния клеток. Например, установлено, что в мотонейронах мух, летающих непрерывно 2 часа, проявляется огромное количество шаровидных митохондрий, а у мух со склеенными крыльями число митохондрий значительно меньше и они имеют палочковидную форму (Л. Б. Левинсон). По форме они могут быть нитевидными, палочковидными, округлыми и гантелеобразными даже в пределах одной клетки.
Митохондрии локализованы в клетке, как правило, либо в тех участках, где расходуется энергия, либо около скоплений субстрата (например, липидных капель), если таковые имеются.
Строгая ориентация митохондрий обнаруживается вдоль жгутиков сперматозоидов, в поперечно-полосатой мышечной ткани, где они располагаются вдоль миофибрилл, в эпителии почечных канальцев локализуются во впячиваниях базальной мембраны и т.д.
Количество митохондрий в клетках имеет органные особенности, например, в клетках печени крыс содержится от 100 до 2500 митохондрий, а в клетках собирательных канальцев почки - 300, в сперматозоидах различных видов животных от 20 до 72, у гигантской амебы Chaos chaos их число достигает 500 000. Размеры митохондрий колеблются от 1 до 10 мкм.
Ультрамикроскопическое строение митохондрий однотипно, независимо от их формы и размера. Они покрыты двумя липопротеидными мембранами: наружной и внутренней. Между ними располагается межмембранное пространство.
Впячивания внутренней мембраны, которые вдаются в тело митохондрий, называются кристами . Расположение крист в митохондриях может быть поперечным и продольным. По форме кристы могут быть простыми и разветвленными. Иногда они образует сложную сеть. В некоторых клетках, например, в клетках клубочковой зоны надпочечника кристы имеют вид трубочек. Количество крист прямо пропорционально интенсивности окислительных процессов, протекающих в митохондриях. Например, в митохондриях кардиомиоцитов их в несколько раз больше, чем в митохондриях гепацитов. Пространство, ограниченное внутренней мембраной, составляет внутреннюю камеру митохондрий. В нем между кристами находится митохондриальный матрикс - относительно электронно плотное вещество.
Белки внутренней мембраны синтезируются миторибосомами, а белки внешней мембраны - циторибосомами.
"Наружная мембрана митохондрий по многим показателям сходна с мембранами ЭПС. Она бедна окислительными ферментами. Немного их и в мембранном пространстве. Зато внутренняя мембрана и митохондриальный матрикс буквально насыщены ими. Так, в матриксе митохондрий сосредоточены ферменты цикла Кребса и окисления жирных кислот. Во внутренней мембране локализована цепь переноса электронов, ферменты фосфорилирования (образования АТФ из АДФ), многочисленные транспортные системы.
Кроме белка и липидов, в состав мембран митохондрий входит РНК, ДНК, последняя обладает генетической специфичностью, и по своим физико-химическим свойствам отличается от ядерной ДНК.
При электронно-микроскопических исследованиях обнаружено, что поверхность наружной мембраны покрыта мелкими шаровидными элементарными частицами. Внутренняя мембрана и кристы содержат подобные элементарные частицы на «ножках», так называемые грибовидные тельца. Они -состоят из трех частей: головки сферической формы (диаметр 90-100 А°), ножки цилиндрической формы, длиной 5 нм и шириной 3-4 нм, основания, имеющего размеры 4 на 11 нм. Головки грибовидных телец связаны с фосфорилированием, затем обнаружено, что головки содержат фермент, обладающий АТФ-идной активностью.
В межмембранном пространстве находится вещество, обладающее более низкой электронной плотностью, чем матрикс. Оно обеспечивает сообщение между мембранами и поставляет для ферментов, находящихся в обеих мембранах, вспомогательные катализаторы-коферменты.
В настоящее время известно, что наружная мембрана митохондрий хорошо проницаема для веществ, имеющих низкий молекулярный вес, в частности, белковых соединений. Внутренняя мембрана митохондрий обладает избирательной проницаемостью. Она практически непроницаема для анионов (Cl -1 , Br -1 , SO 4 -2 , HCO 3 -1 , катионов Sn +2 , Mg +2 , ряда cахаров и большинства аминокислот, тогда как Са 2+ , Мп 2+ , фосфат, многокарбоновые кислоты легко проникают через нее. Имеются данные о наличии во внутренней мембране нескольких переносчиков, специфических к отдельным группам проникающих анионов и катионов. Активный транспорт веществ через мембраны осуществляется благодаря использованию энергии АТФ-азной системы или электрического потенциала, генерируемого на мембране в результате работы дыхательной цепи. Даже АТФ, синтезированная в митохондриях, может выйти с помощью переносчика (сопряженный транспорт).
Матрикс митохондрий представлен мелкозернистым электронно-плотным веществом. В нем располагаются миторибосомы, фибриллярные структуры, состоящие из молекул ДНК и гранул, имеющих диаметр более 200А ◦ образованные солями: Ca 3 (PO 4) , Ba 3 (PO 4) 2 , Mg 3 (PO 4) . Полагают, что гранулы служат резервуаром ионов Са +2 и Мg +2 . Их количество увеличивается при изменении проницаемости митохондриальных мембран.
Присутствие в митохондриях ДНК обеспечивает участие митохондрий в синтезе РНК и специфических белков, а также указывает на существование цитоплазматической наследственности. Каждая митохондрия содержит в зависимости от размера одну или несколько молекул ДНК (от 2 до 10). Молекулярный вес митохондриальной ДНК около (30-40)*10 6 у простейших, дрожжей, грибов. У высших животных около (9–10) *10 6.
Длина ее у дрожжей примерно равна 5 мкм, у растений - 30 мкм. Объем генетической информации, заключенный в митохондриальной ДНК, невелик: он состоит из 15-75 тыс. пар оснований, которые могут кодировать в среднем 25-125 белковых цепей с молекулярным весом около 40000.
Митохондриальная ДНК отличается от ядерной ДНК рядом особенностей: более высокой скоростью синтеза (в 5-7 раз), она более устойчива к действию ДНК-азы, представляет собой двухкольцевую молекулу, содержит больше гуанина и цитозина, денатурируется при более высокой температуре и легче восстанавливается. Однако не все митохондриальные белки синтезируются митохондриальной системой. Так, синтез цитохрома С и других ферментов обеспечивается информацией, содержащейся в ядре. В матриксе митохондрий локализованы, витамины А, В 2 , В 12 , К, Е, а также гликоген.
Функция митохондрий заключается в образовании энергии, необходимой для жизнедеятельности клеток. Источником энергии в клетке могут служить различные соединения: белки, жиры, углеводы. Однако единственным субстратом, который немедленно включается в энергетические процессы, является глюкоза.
Биологические процессы, в результате которых в митохондриях образуется энергия, можно подразделить на 3 группы: I группа - окислительные реакции, включающие две фазы: анаэробную (гликолиз) и аэробную. II группа - дефосфорилирование, расщепление АТФ и высвобождение энергии. III группа - фосфорилирование, сопряженное с процессом окисления.
Процесс окисления глюкозы вначале происходит без участия кислорода (анаэробным или гликолитическим путем) до пировиноградной или молочной кислоты.
Однако при этом энергии выделяется лишь небольшое количество. В дальнейшем эти кислоты вовлекаются в процессы окисления, которые протекают с участием кислорода, т. е. являются аэробными. В результате процесса окисления пировиноградной и молочной кислоты, названной циклом Кребса, образуется углекислый газ, вода и большое количество энергии.
Образующаяся энергия не выделяется в виде тепла, что привело бы к перегреванию клеток и гибели всего организма, а аккумулируется в удобной для хранения и транспорта форме в виде аденозинтрифосфорной кислоты (АТФ). Синтез АТФ происходит из АДФ и фосфорной кислоты и вследствие этого называется фосфорилированием .
В здоровых клетках фосфорилирование сопряжено с окислением. При заболеваниях сопряженность может разобщаться, поэтому субстрат окисляется, а фосфорилирование не происходит, и окисление переходит в тепло, а содержание АТФ в клетках снижается. В результате повышается температура и падает функциональная активность клеток.
Итак, основная функция митохондрий заключается в выработке практически всей энергии клетки и происходит синтез компонентов, необходимых для деятельности самого органоида, ферментов «дыхательного ансамбля», фосфолипидов и белков.
Еще одной стороной деятельности митохондрий является их участие в специфических синтезах, например, в синтезе стероидных гормонов и отдельных липидов. В ооцитах разных животных образуются скопления желтка в митохондриях, при этом они утрачивают свою основную систему. Отработавшие митохондрии могут накапливать также продукты экскреции.
В некоторых случаях (печень, почки) митохондрии способны аккумулировать вредные вещества и яды, попадающие в клетку, изолируя их от основной цитоплазмы и частично блокируя вредное действие этих веществ. Таким образом, митохондрии способны брать на себя функции других органоидов клетки, когда это требуется для полноценного обеспечения того или иного процесса в норме или в экстремальных условиях.
Биогенез митохондрий. Митохондрии представляют собой обновляющиеся структуры с довольно кратким жизненным циклом (в клетках печени крысы, например, период полужизни митохондрий охватывает около 10 дней). Митохондрии образуются в результате роста и деления предшествующих митохондрий. Деление их может происходить тремя способами: перетяжкой, отпочковыванием небольших участков и возникновением дочерних митохондрий внутри материнской. Делению (репродукции) митохондрий предшествует репродукция собственной генетической системы - митохондриальной ДНК.
Итак, согласно взглядам большинства исследователей, образование митохондрий происходит преимущественно путем саморепродукции их de novo.











