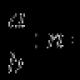Das Verfahren zur Gewinnung von Soda. Technologisches Schema zur Gewinnung von Kalkmilch. Technologisches Schema der Filtrationsabteilung
Physikalisch-chemische Grundlagen des Verfahrens
Das bei der Karbonisierung ausgefallene Natriumbicarbonat wird auf herkömmlichen Trommelvakuumfiltern von der Mutter-(Filter-)Flüssigkeit getrennt und beim Erhitzen zersetzt bzw. kalziniert.
Erfahrungsgemäß kann Ammoniak durch Waschen des Niederschlags nicht ausgewaschen werden, er kann auch bei Erwärmung auf 100 °C nicht vollständig entfernt werden. Mit Hilfe der Chemo
Durch chemische Analysen wurde festgestellt, dass Ammoniak in technischem Kohlenwasserstoff in Form von Natriumcarbamat vorliegt. Seine Freisetzung in die feste Phase erfolgt während des gesamten Prozesses der NaHCO3-Kristallisation in der Karbonisierungskolonne, d. h. Natriumcarbamat fällt zusammen mit Natriumbicarbonat aus. Seine Kristalle sind im Kristallgitter von NaHCO3 enthalten, was die Schwierigkeit erklärt, Ammoniak durch Waschen zu entfernen.
Natriumcarbonat Na2CO3 kann durch Hydrolyse von NaHCO3 und Entkarbonisierung von gelöstem NaHCO3 auf einem Filter gebildet werden. Das Vorhandensein von Na2CO3 in technischem Kohlenwasserstoff kann nicht durch die Kristallisation von Na2CO3 während der Verkokung erklärt werden, da die CO32~-Konzentration in der verkokten Lösung gering ist.
Mit einer Abnahme des CO2-Drucks über der Suspension am Ausgang der Karbonisierungssäule und am Vakuumfilter tritt der Prozess der Retrogradation auf, dh der Übergang von ausgefälltem NaHCO3 in Lösung und seine Wechselwirkung mit NH4C1. Dadurch und auch durch die Auflösung von NaHCO3 im Waschwasser wird eine Erhöhung des direkten Titers der Flüssigkeit nach den Filtern um 0,5-1,5 N beobachtet. obwohl es mit Waschwasser verdünnt und etwas Ammoniak auf den Filter geblasen wurde. Die Ausnutzungsrate (f/Na) nach den Filtern ist um etwa 2,5 % reduziert im Vergleich zu der der die Säule verlassenden Aufschlämmung, wo U^a durchschnittlich 73 % beträgt. Folglich erreicht der Verlust von NaHCO3 auf den Filtern ungefähr 3,5 %.
Der filtrierte und gewaschene Niederschlag von Natriumbicarbonat wird thermisch zersetzt - Kalzinierung. Trockenes NaHCO3 zersetzt sich gemäß der Reaktion:
Mit steigender Temperatur verschiebt sich das Reaktionsgleichgewicht nach rechts. Aus Sicht der Phasenregel hat dieses System einen Freiheitsgrad. Folglich hängt der Gleichgewichtsdruck der Gasphase nur von der Temperatur ab.
Während der Zersetzung von feuchtem Bicarbonat erhöht sich die Anzahl der Komponenten und Phasen um eins, und folglich bleibt das System monovariant, d. h. für das feuchte NaHCO3-Salz entspricht jede Temperatur einem bestimmten Gleichgewichtsdruck der Gasphase.
Die Feuchtigkeit im Kohlenwasserstoff ist im Wesentlichen seine gesättigte Lösung, sodass der Gleichgewichtsdruck der Gasphase über nassem NaHCO3 durch den Gleichgewichtsdruck über einer gesättigten Lösung dieses Salzes bestimmt wird. Bei dieser Temperatur ist dieser Druck höher als bei übertrockenem Kohlenwasserstoff. Beim Erhitzen von feuchtem Salz zersetzt sich daher zunächst das gelöste Bikarbonat, wobei nicht nur Feuchtigkeit, sondern auch Kohlendioxid in die Gasphase freigesetzt wird (Abb. 38). Nach dem Entfernen von Feuchtigkeit nimmt der Gleichgewichtsdruck über dem verbleibenden trockenen Bicarbonat ab, und daher wird seine Zersetzung schwierig. Unter Verwendung von Thermogrammen wurde festgestellt, dass die Zersetzung von trockenem NaHCO 3 bei einem Gesamtdruck von gebildetem CO 2 und H 2 O gleich 98 kPa (1 kgf/cm 2 ) bei 120°C gemäß Reaktion (1) fortschreitet.
Nasses NaHCO3, wie aus Abb. 38 kann sich auch bei 110°C zersetzen. Durch den Zugang von Luft oder anderem Gas zur Zersetzungszone, die den Gesamtdruck Pco2 + Pn2o über dem Sediment verringert, kann die Zersetzung bei niedrigeren Temperaturen ablaufen.
TECHNOLOGISCHES SCHEMA DES KALZINIERUNGSPROZESSES
Auf Abb. Dargestellt ist das technologische Schema des Kalzinierungsprozesses unter Verwendung von befeuerten Öfen mit externer Fackelheizung, die unter Verwendung von Rücknatron arbeiten.
Die in den Kolonnen erhaltene Suspension, die 26 Gew.-% ausgefälltes NaHCO 3 enthält, tritt in die Vakuumfilter 6 ein, wo das Präzipitat von der Mutterlauge getrennt wird. Zusammen mit dem Waschwasser wird die Mutterlauge zur Ammoniak-Regeneration in die Destillationsabteilung geleitet. Die Luft, die die Sedimentschicht und das Filtertuch passiert hat, wird mit einer Vakuumpumpe durch den im Absorptionsteil befindlichen Filterluftwäscher (PVFL) aus dem Filterabscheider abgesaugt.
Das gewaschene Roh-NaHCO3 aus dem Vakuumfilter wird über einen Kratz- oder Bandförderer 4 der Vorlage 3 mit vertikalem Rührwerk zugeführt, das das Rohsalz auflockert und in die Zuführung 2 und weiter in den Mischer / drückt. Dabei wird der Förderschnecke 7 heiße Rücklaufsoda in einem vorgegebenen Verhältnis zugeführt. Die resultierende Mischung tritt dann in den Drehtrommel-Sodaofen 22 ein, wo der Kalzinierungsprozess stattfindet.
Das fertige Soda aus dem Sodaofen wird mit Hilfe der Entladeschnecke 17 und der Transferschnecke 18 auf den gemeinsamen kombinierten Schneckenförderer 19 und dann auf den Elevator 16 übertragen. Der Elevator entlädt das Soda auf den Förderer Und, von dem, Unter Verwendung der Verteilerschnecke 9 wird ein Teil der Soda (retur) über die Sodaöfen verteilt, und ein Teil – fertige Produkte – wird in Trichtern 15 durch Förderband 8 in das Lager überführt Rohkohlenwasserstoff zu den Öfen und fertige Soda ist etwas anders, aber für die Betriebsbedingungen des Rücklaufofens ist dies von grundlegender Bedeutung.

Technologisches Schema der Kalzinierungsabteilung mit Rückführung von Sodaöfen: 1 - Mischer; 2 - Zubringer; 3 - Empfänger; 4 - Kratzförderer; 5 - Bunker 6 - Vakuumfilter; 7, 11, 18, 19 - Schneckenförderer; 8, 9 - Transportrohre - "10 - Zyklon; 12 - Gassammler von Sodaöfen; 13 - Gaskühler von Sodaöfen - 14 - Gaswäscher von Sodaöfen; 15 - Sammlung von schwacher Flüssigkeit - 16 - Aufzug, 17 - Entladen Schnecke; 20 - Schweine; 21 - Rauchabzug; 22 - Sodaofen - 23 - Feuerraum
Das die Sodaöfen bei 150°C verlassende Gas enthält CO2, NH3, Wasserdampf und Sodastaub und wird zum Zyklon 10 geleitet, wo der größte Teil des Sodastaubs aufgefangen und durch einen Schneckenförderer 7 zurück in den Sodaofen befördert wird Zyklon, das Gas tritt in den gemeinsamen aller Öfen ein, der Gaskanal 12 ist der Gassammler von Sodaöfen, der innen mit einer schwachen Flüssigkeit bewässert wird, die durch Abkühlen des Gases im selben Sammler auf 80 ° C und dann im Gas erhalten wird Kühler von Sodakochern (HGSP) 13 bis 38 °C.
Das entstehende Kondensat entzieht dem Gas Natronstaub, NH3 und CO2, die nach dem Zyklon zurückbleiben. Diese Lösung, die Na2C03, NaHCO3 und Ammoniumkohlenstoffsalze enthält, wird als schwache Flüssigkeit bezeichnet. Ein Teil dieser Flüssigkeit wird zur Bewässerung in den Gassammler der Sodaöfen zurückgeführt, ein Teil wird zur Destillation von NH3 und CO2 in die Destillationsabteilung und dann zu Vakuumfiltern zum Waschen von Natriumbicarbonat geleitet.
Der Gassammler von Sodakochern hat ein Gefälle zum CHGSP-Kühlschrank, daher fließt eine schwache Flüssigkeit aus dem Sammler in den Kühlschrank, bewässert die Kühlrohre und fließt zusammen mit dem zusätzlich im Kühlschrank 13 gebildeten Kondensat in die Sammlung von schwache Flüssigkeit 15. In der Kältemaschine 13 strömt das Gas im Ringraum 14 von oben nach unten und Kühlwasser fließt im Gegenstrom in den Rohren.
3.4.1 Physikalische und chemische Grundlagen des Verfahrens
Das bei der Karbonisierung ausgefallene Natriumbicarbonat wird auf herkömmlichen Trommelvakuumfiltern von der Mutter-(Filter-)Flüssigkeit getrennt und beim Erhitzen zersetzt bzw. kalziniert.
Filtriertes und gewaschenes Natriumbicarbonat enthält folgende Stoffe (in Gew.-%):
Eigentlich Natriumbicarbonat - 76-80;
Carbonate (in Bezug auf Natriumcarbonat) - 2-6;
Gesamtammoniak - 0,6-0,8;
Gesamtchloridion (bezogen auf Natriumchlorid) - 0,2-0,4;
Wasser - 14-18.
Ammoniak kann erfahrungsgemäß nicht durch Waschen des Niederschlags ausgewaschen werden, er kann auch bei Erwärmung auf 100 °C nicht vollständig entfernt werden. Anhand chemischer Analysedaten wurde festgestellt, dass Ammoniak in technischem Natriumbicarbonat in Form von Natriumcarbamat vorliegt. Seine Trennung in die feste Phase erfolgt während des gesamten Kristallisationsprozesses in der Karbonisierungskolonne, d. h. Natriumcarbamat fällt zusammen mit Natriumbicarbonat aus. Seine Kristalle sind im Kristallgitter von Natriumbicarbonat enthalten, was die Schwierigkeit erklärt, Ammoniak durch Waschen zu entfernen.
Natriumcarbonat Na 2 CO 3 kann bei der Hydrolyse von Natriumbicarbonat und der Entkarbonisierung von gelöstem Natriumbicarbonat auf Filtern gebildet werden. Das Vorhandensein von Natriumcarbonat in technischem Hydrokarbonat kann aufgrund der geringen Konzentration des Carbonations in der carbonisierten Lösung nicht durch seine Kristallisation während der Karbonisierung erklärt werden.
Mit einer Abnahme des Kohlendioxiddrucks über der Suspension am Ausgang der Schwelsäule und am Vakuumfilter tritt der Prozess der Retrogradation auf, d. H. Der Übergang von ausgefälltem Natriumbicarbonat in Lösung und seine Wechselwirkung mit Ammoniumchlorid. Dadurch und auch durch die Auflösung von Natriumbicarbonat im Waschwasser wird trotz Verdünnung mit Waschwasser und Ausblasen eine Erhöhung des Direkttiters der Flüssigkeit nach den Filtern um 0,5-1,5 n.d. beobachtet bestimmte Menge Ammoniak auf dem Filter. Der Nutzungsgrad von U N a nach den Filtern ist im Vergleich zu diesem Indikator für die die Kolonne verlassende Suspension, wo U N a durchschnittlich 73 % beträgt, um etwa 2,5 % reduziert. Folglich erreicht der Verlust an Natriumbicarbonat auf den Filtern etwa 3,5 %.
Der filtrierte und gewaschene Niederschlag von Natriumbicarbonat wird thermisch zersetzt - Kalzinierung. Trockenes Natriumbicarbonat zersetzt sich gemäß der Reaktion:
2NaHSO 3 (tv.) → Na 2 CO 3 (tv.) + CO 2 (g) + H 2 O (p) – 125,6 kJ. (3.7)
Mit steigender Temperatur verschiebt sich das Reaktionsgleichgewicht nach rechts. Aus Sicht der Phasenregel hat dieses System einen Freiheitsgrad. Folglich hängt der Gleichgewichtsdruck der Gasphase nur von der Temperatur ab. Während der Zersetzung von feuchtem Natriumbicarbonat erhöht sich die Anzahl der Komponenten und Phasen um eins, und folglich bleibt das System monovariant, d. h. für ein feuchtes Salz entspricht jede Temperatur einem bestimmten Gleichgewichtsdruck der Gasphase.
Die Feuchtigkeit in Natriumbicarbonat ist im Wesentlichen seine gesättigte Lösung, sodass der Gleichgewichtsdruck der Gasphase über einem feuchten Salz durch den Gleichgewichtsdruck über einer gesättigten Lösung dieses Salzes bestimmt wird. Bei dieser Temperatur ist dieser Druck höher als bei trockenem Natriumbicarbonat. Daher zersetzt sich beim Erhitzen von feuchtem Salz zunächst gelöstes Natriumbicarbonat, wobei nicht nur Feuchtigkeit, sondern auch Kohlendioxid in die Gasphase freigesetzt wird. Nach dem Entfernen von Feuchtigkeit nimmt der Gleichgewichtsdruck über dem verbleibenden trockenen Natriumbicarbonat ab, und daher wird seine Zersetzung schwierig. Unter Verwendung von Thermogrammen wurde festgestellt, dass die Zersetzung von trockenem Kohlenwasserstoff bei einem Gesamtdruck von gebildetem Kohlendioxid und Wasserdampf gleich 98 kPa (1 kgf / cm 2) bei einer Temperatur von 120 ° C gemäß Reaktion (3.7) abläuft.
Nasses Natriumbicarbonat kann sich auch bei 110 °C zersetzen. Durch den Zugang von Luft oder anderem Gas zur Zersetzungszone, das den Gesamtdruck Pco 2 + Pn 2 etwa über dem Sediment reduziert, kann die Zersetzung bei niedrigeren Temperaturen ablaufen.
Unter praktischen Bedingungen wird der Kalzinierungsprozess von rohem technischem Natriumbicarbonat durch das Vorhandensein von Verunreinigungen erschwert, und eine große Menge an Feuchtigkeit, die Salzklumpen verursacht, beeinträchtigt seinen Misch- und Wärmeübertragungsprozess. Außerdem wird beim Verdampfen von Feuchtigkeit, bei der es sich um eine gesättigte Salzlösung handelt, eine feste Phase freigesetzt, die an den Ofenwänden kristallisiert und eine Kruste bildet, die fest an der Wandoberfläche haftet. Eine harte Salzschicht, die schlecht wärmeleitend ist, beeinträchtigt die Wärmeübertragung und kann zum Ausbrennen der von außen beheizten Stahlofenwand führen. Um diese Mängel zu beseitigen, wird rohes technisches Bicarbonat vor der Kalzinierung mit fertiger heißer Soda (Rücknatron) gemischt. In diesem Fall wird, wie mikroskopische und Röntgenuntersuchungen zeigen, eine neue feste Phase gebildet - der Thron von Na 2 CO 3 × NaHCO 3 × 2H 2 O:
NaHCO 3 (tv.) + Na 2 CO 3 (tv.) + 2H 2 O (l) → Na 2 CO 3 × NaHCO 3 × 2H 2 O (tv.)
21,9 kJ. (3.8)
So geht die hygroskopische Feuchtigkeit des Natriumbicarbonats bei der Bildung von Trona in Kristallwasser über. Die Mischung wird trocken, krümelig und die Calcinierung einer solchen Mischung verläuft ohne Komplikationen. Die Zersetzung der Trona verläuft nach der Reaktion:
3 (Na 2 CO 3 × NaHCO 3 × 2 H 2 O) (s.) → Na 2 CO 3 × 3 NaHCO 3 (s.) + 2 Na 2 CO 3 (s.) + 6 H 2 O (g) – 320,3 kJ. (3.9)
gefolgt von der Zersetzung des Doppelsalzes zu Natriumcarbonat Na 2 CO 3 .
Daher sollte der Kalzinierungsprozess in der Praxis bei einer Temperatur von nicht weniger als 126°C durchgeführt werden. Um den Vorgang jedoch zu beschleunigen, wird die Temperatur auf 140 °C oder mehr erhöht.
Technisches Natriumbicarbonat enthält neben Feuchtigkeit auch Natriumcarbamat, dessen Kristalle in seinem Kristallgitter eingeschlossen sind. Bei der Bildung der Trona wird das Kristallgitter des Bicarbonats zerstört und das Carbamat zersetzt sich in Gegenwart von Wasserdampf leicht zu Natriumcarbonat Na 2 CO 3 .
Mit der Filterflüssigkeit gelangen Verunreinigungen aus Karbonat und Ammoniumchlorid in technisches Natriumbikarbonat. Ammoniumcarbonat wird leicht zersetzt und Ammoniumchlorid reagiert mit Natriumbicarbonat, wodurch das Soda mit dem resultierenden Natriumchlorid verunreinigt wird. So treten bei der Kalzinierung von technischem Natriumbicarbonat neben den oben genannten Reaktionen auch folgende Hauptreaktionen auf:
2NaHSO 3 \u003d Na 2 CO 3 + CO 2 + H 2 O,
NH 4 C1 + NaHCO 3 \u003d NaC1 + NH 3 + H 2 O + CO 2.
Die Reaktionen (3.9) laufen am leichtesten ab, und die letzten, etwas schwierigeren anderen Reaktionen und schließlich die langsamste, die Geschwindigkeit des gesamten Prozesses begrenzende Reaktion der Doppelsalzzersetzung.
Untersuchungen zur Kinetik des Kalzinierungsprozesses zeigen, dass die Zersetzung von Natriumbicarbonat hauptsächlich im thermischen Bereich abläuft, d. h. die Zersetzungsgeschwindigkeit von der Rate der Wärmezufuhr zur Zersetzungszone abhängt, d. h. von der spezifischen Wärmeaustauschfläche, ihrer Temperatur und hydrodynamischen Bedingungen. Unter praktischen Bedingungen erfordert jedoch die vollständige Zersetzung von Natriumbicarbonat in Gegenwart von Rücknatron eine viel längere Zeit.
3.4.2 Technologisches Schema der Karbonisierungsabteilung
Abbildung 3.4 zeigt ein Flussdiagramm des Kalzinierungsprozesses mit befeuerten Öfen mit externer Fackelbeheizung, die mit Rücknatron arbeiten.
Abbildung 3.4 - Technologisches Schema der Kalzinierungsabteilung
In Säulen erhaltene Suspension mit 26 Gew.-% ausgefälltes Natriumbicarbonat, tritt in die Vakuumfilter 6 ein, wo das Präzipitat von der Mutterlauge getrennt wird. Zusammen mit dem Waschwasser wird die Mutterlauge zur Ammoniak-Regeneration in die Destillationsabteilung geleitet. Die Luft, die die Sedimentschicht und das Filtertuch passiert hat, wird durch eine Vakuumpumpe durch den Luftwäscher der PVFL-Filter, der sich in der Ammoniak-Absorptionssektion befindet, aus dem Filterabscheider gesaugt.
Das gewaschene Roh-Natriumcarbonat aus dem Vakuumfilter wird über einen Kratzer oder Bandförderer 4 der Vorlage 3 mit einem vertikalen Rührwerk zugeführt, das das Rohsalz auflockert und in die Zuführung 2 und weiter in den Mischer 1 drückt. Heiße Rücknatron ist ebenfalls hier von der Förderschnecke 7 in einem bestimmten Verhältnis zugeführt. Die resultierende Mischung tritt dann in den Drehtrommel-Sodaofen 22 ein, wo der Kalzinierungsprozess stattfindet.
Fertige kalzinierte Soda aus dem Sodaofen wird mit Hilfe der Entladeschnecke 17 und der Transferschnecke 18 auf den gemeinsamen Montageschneckenförderer 19 und dann auf den Elevator 16 übertragen. Der Elevator entlädt die Soda auf den Förderer 11, von dem Mit der Verteilungsschnecke 9 wird ein Teil des Sodas (Rücklaufsoda) durch Sodaöfen verteilt und ein Teil - fertige Produkte - wird über das Förderband 8 in das Lager in den Bunkern 5 transportiert.
Das aus Sodaöfen bei 150°C austretende Gas enthält Kohlendioxid, Ammoniak, Wasserdampf und Sodastaub. Dieses Gas wird zum Zyklon 10 geleitet, wo der größte Teil des Sodastaubs aufgefangen und durch einen Schneckenförderer 7 zum Sodaofen zurückgeführt wird. Aus dem Zyklon tritt das Gas in den Gaskanal 12 ein, der allen Öfen gemeinsam ist - dem Gassammler für Soda Öfen, die innen mit einer schwachen Flüssigkeit bewässert werden, die durch Abkühlen des Gases im selben Kollektor auf eine Temperatur von 80 ° C und dann im Gaskühler der Sodaöfen KhGSP 13 auf eine Temperatur von 38 ° C erhalten wird.
Das entstehende Kondensat entzieht dem Gas den nach dem Zyklon verbliebenen Natronstaub, Ammoniak und Kohlendioxid. Diese Lösung, die Bicarbonat und Natriumcarbonat, Ammoniumcarbonatsalze, enthält, wird als schwache Flüssigkeit bezeichnet. Ein Teil dieser Flüssigkeit wird zur Bewässerung des Gassammlers von Sodaöfen zurückgeführt, und ein Teil wird zur Destillationsabteilung zum Strippen von Ammoniak und Kohlendioxid geleitet, wonach sie zu Vakuumfiltern zum Waschen von Natriumbicarbonat geleitet wird.
Der Gassammler von Sodaöfen hat ein Gefälle zum Gaskühler von CHGSP-Sodaöfen, daher fließt eine schwache Flüssigkeit aus dem Sammler in den Kühlschrank, bewässert die Kühlrohre und fließt zusammen mit dem zusätzlich im Kühlschrank 13 gebildeten Kondensat in die Schwachflüssigkeitssammlung 15. Im Kühler 13 strömt das Gas im Ringraum von oben nach unten, in den Rohren strömt Kühlwasser im Gegenstrom.
Gas aus dem PHAB-Absorptionsgaswäscher wird auch dem Sodagaskühler von HGSP-Öfen zugeführt, um den Nutzungsgrad des nach der Ammonisierung der Sole im Gas verbleibenden Kohlendioxids zu erhöhen. Vom Gaskühler der Sodaöfen KhGSP gelangt das Gas zur Endreinigung und Kühlung zum Gaswäscher der Sodaöfen PGSP 14 vom Typ Scrubber, in dem die Gurtpackung von oben mit Wasser berieselt wird. Die Waschflüssigkeit nach dem Gaswäscher der Sodaöfen SGSP wird der schwachen Flüssigkeit zugesetzt. Das gekühlte und gereinigte Gas nach dem Gaswäscher der PGSP-Sodaöfen wird mit dem Gas der Kalköfen gemischt und über einen Kompressor den Schwelsäulen zugeführt. In manchen Sodaanlagen sind Kühler und Gaswäscher von Sodakochern in einer Säule zusammengefasst.
Seit Anfang des 19. Jahrhunderts Chemiker versuchten, einen Weg zu finden, Soda herzustellen, indem sie Natriumchlorid in Natriumcarbonat umwandelten, ohne Schwefelsäure zu verwenden. 1810 erhielt A. Fresnel Soda durch Einwirkung von Ammoniak und Kohlendioxid auf eine Kochsalzlösung, aber seine Methode wurde nicht industriell. In den 1930er Jahren gingen D. Hamming und G. Dyar denselben Weg. Sie leiteten auch Ammoniak und Kohlendioxid in eine wässrige Kochsalzlösung. Dabei fiel schwerlösliches Natriumbicarbonat aus. NaHCO 3, das sich beim Erhitzen in Soda verwandelte. Für die Industrie stellte sich dieses Verfahren als unrentabel heraus, da keine Möglichkeit gefunden wurde, Ammoniak zu regenerieren.
Schließlich gelang es Ernest Solva, einen Weg zu finden, Ammoniak und etwas Kohlendioxid zurückzugewinnen und den gesamten Prozess kontinuierlich zu machen. Solvay entwickelte neue Anlagen und Maschinen. Als Ergebnis langjähriger Experimente hat er die optimalen Bedingungen für die Erzielung hoher Ausbeuten an Natriumbicarbonat geschaffen.
Der Vater von Ernest Solvay war Besitzer eines Steinbruchs und einer Saline in Rebeke (bei Brüssel). Ernest wurde 1838 geboren. In seiner Jugend war er viel krank und sein Traum – ein Studium der Chemie – musste nur durch Autodidaktik verwirklicht werden. Später arbeitete Solvay im Gaswerk seines Onkels und versuchte, Wege zu finden, um die schädlichen Nebenprodukte der Gasproduktion (insbesondere Ammoniakwasser) zu entsorgen. Außerdem suchte Solvay nach einer Möglichkeit, Soda aus einer Lösung von Natriumchlorid, Ammoniak und Kohlendioxid zu gewinnen.
Die Vorteile des von Solvay entwickelten Ammoniak-Verfahrens zur Herstellung von Soda lagen auf der Hand. Erstens erforderte dieses Verfahren viel niedrigere Temperaturen und führte somit zu Kohleeinsparungen. Zweitens konnten bei diesem Verfahren anstelle von gereinigtem Speisesalz Solen verwendet werden, deren Kosten viel geringer waren. Drittens umfasste das Solvay-Verfahren weniger Stufen und, was sehr wichtig ist, es wurde keine Schwefelsäure benötigt. Schließlich verursachte das Solvay-Verfahren keine Umweltverschmutzung und produzierte Soda von sehr hoher Reinheit. Vergleichen wir die Hauptphasen beider Methoden.
Produktionsstufen nach dem Leblanc-Verfahren:
- 2NaC1 + H 2 SO 4 \u003d Na 2 SO 4 + 2HC1 (bei dunkelroter Hitze).
- Na 2 SO 4 + 3C + CaO \u003d Na 2 CO3 + CaS + 2CO (Temperatur bis 960 ° C).
- Auswaschung.
- Verdampfung und Kristallisation von Na 2 CO 3 ∙10H 2 O.
- Kalzinierung unter Bildung von Na 2 CO 3 .
- Teilrückgewinnung von Schwefel aus Calciumsulfid.
Produktionsschritte nach dem Solvay-Verfahren:
- NaС1 + NH 3 + CO 2 + H 2 O = NаНСО 3 + NH 4 С1 (Bildung von NaНСО 3 erfolgt in wässriger Lösung bei 30-40°С).
- Kalzinierung unter Bildung von Soda: 2NaHCO 3 \u003d Na 2 CO 3 + CO 2 + H 2 O (CO 2 bleibt teilweise in einem geschlossenen Prozess).
- Ammoniak-Regeneration: 2NH 4 C1 + CaO = CaC1 2 + H 2 0 + 2NH 3.
Trotz der Vorteile Solvay-Methode hatte sein Autor zunächst große Schwierigkeiten. Die von ihm 1863 in der Nähe der Stadt Charleroi (Belgien) gegründete Fabrik erschöpfte das gesamte Familienkapital. Erst nach der Gründung der Aktiengesellschaft Solvay & Co. im Jahr 1865 konnten die nach dieser Methode hergestellten Produkte erfolgreich mit den nach der Leblanc-Methode arbeitenden Unternehmen konkurrieren und sie dann auf dem internationalen Markt schlagen. Bald entstanden in fast allen Ländern Anlagen zur Herstellung von Soda nach dem Solvay-Verfahren: in England (1871), Frankreich (1874), Deutschland, bei Vilhen in Baden (1880) und um Bernburg (1883), USA (1881), Russland (1883). Wie Alfred Nobel wurde Solvay zu einem der reichsten und mächtigsten Menschen der Welt. Er gründete ein gut ausgestattetes Forschungsinstitut, führte 1908 in seinen Fabriken einen Dreischichtbetrieb mit einem Achtstundentag ein. Die Monopolstellung der Eigentümer dieser Unternehmen verschaffte ihnen enorme Gewinne. Der Solvay-Konzern wurde zu einem der mächtigsten Chemieunternehmen.
Kalzinierung von Natriumbicarbonat. Die Kalzinierung – die thermische Zersetzung von Natriumbicarbonat – ist die letzte Stufe bei der Herstellung von Soda. Der Hauptzweck der Kalzinierungsabteilung besteht darin, eine bestimmte Menge Soda in Form eines kontinuierlichen Materialflusses zu erhalten.
Technisches Natriumbicarbonat sollte weiß sein. Das Auftreten von Farbe weist auf Korrosion der Stahlbehälter in den Absorptions- und Karbonisierungsabschnitten hin. Der Niederschlag wird durch Eisenoxid gefärbt, das durch Korrosion in ihn gelangt.
Der Kalzinierungsprozess kann durch die Gleichung 2 NaHCO3 tv dargestellt werden. Na2CO3-Fernseher. CO2-Gas H2O-Dampf Neben dieser Hauptreaktion können beim Erhitzen von technischem Bikarbonat weitere Reaktionen ablaufen NH4 2CO3-2NH3-Gas CO2-Gas H2O-Dampf, NH4 HCO3-2NH3-Gas CO2-Gas H2O-Dampf. Ammoniumchlorid reagiert beim Erhitzen mit Natriumbicarbonat im Reaktions-NH4Cl-Sol.
NaHCO3 tv -NaCl tv NH3 CO2-Gas H2O-Gas. Natriumcarbamat geht in Gegenwart von Wasser beim Erhitzen gemäß der Reaktion 2NaCO2NH2 H2O-Na2CO3 fest in Soda über. CO2-Gas 2NH3-Gas. Durch die Kalzinierung verbleiben also Na2CO3 und NaCl in der festen Phase, während NH3, CO2 und H2O in die Gasphase übergehen. Das Vorhandensein von Feuchtigkeit im Bicarbonat erschwert die Instrumentierung, da feuchtes Natriumbicarbonat schlecht fließt, klumpt und an den Wänden der Apparatur haftet.
Letzteres erklärt sich aus der Tatsache, dass Feuchtigkeit, die eine gesättigte Lösung von NaHCO3 ist, beim Kontakt mit einer heißen Oberfläche schnell verdunstet.
Die ausgefallene feste Phase bildet beim Kristallisieren eine Kruste, die fest an der Oberfläche haftet. Eine feste Sodaschicht, die eine geringe Wärmeleitfähigkeit hat, beeinträchtigt die Wärmeübertragung und führt bei von außen durch Rauchgase beheizten Sodaöfen zu einer Überhitzung und einem Ausbrennen der Ofenwand. Um dieses Phänomen zu bekämpfen, wird feuchtes Natriumbicarbonat mit heißem Retur-Soda gemischt. In diesem Fall wird eine neue feste Phase gebildet - der Thron NaHCO3 Na2CO3 2 H2O. Durch Kristallisation wird freie Feuchtigkeit gebunden und das Produkt wird rieselfähig. Bei der Kalzinierung von Natriumbicarbonat und Trona werden CO2, NH3 und Wasserdampf in die Gasphase freigesetzt. Ammoniak und Kohlendioxid sollten der Produktion wieder zugeführt werden.
Kohlendioxid wird im Verfahren der Ammoniak-Sole-Karbonisierung verwendet, für die es nützlich ist, ein Gas mit einem hohen CO2-Gehalt zu haben. Der Kristallisationsprozess lässt sich in drei Zeiträume einteilen. Die erste Periode ist durch einen schnellen Temperaturanstieg gekennzeichnet. Die Zersetzung von Bicarbonat wird nicht beobachtet, und die gesamte Wärme wird zum Erhitzen des Materials, zum Entfernen des Kristallisationswassers aus der Trona und zum Zersetzen der Kohlenstoffammoniumsalze aufgewendet.
Die zweite Periode ist durch die Konstanz der Temperatur des Materials t 125 C gekennzeichnet. Die zugeführte Wärme wird für die thermische Zersetzung von NaHCO3 aufgewendet. In der dritten Periode beginnt die Temperatur der Reaktionsmasse stark anzusteigen. Dies zeigt an, dass der Zersetzungsprozess von Bicarbonat beendet ist und die zugeführte Wärme zum Erhitzen der resultierenden Soda verwendet wird. Um den Zersetzungsprozess von NaHCO3 zu beschleunigen, wird in der Praxis die Sodatemperatur am Ausgang des Ofens zwischen 140 und 160 ° C gehalten. Technologisches Schema des Kalzinierungsprozesses Abb. 11. Kalzinierungs-Trennschema 1- Dampfkondensator 2- Futtermischer 3.15 - Zellbeschicker 4.10 - Bandförderer 5 - Vibrationsrinne 6-Schurren-Bunker 7-Pflugauswerfer 8,9,14,16-Förderer 11-Zyklon 12-Sammler Kalzinierung Gas 13-Separator 17-Kondensatsammler 18-Zentrifugalpumpen 19-Schwachflüssigkeitssammler 20-Kalzinierungsgaskühler 21-Reduzierkühleinheit ROU 22-Kalzinierungsgaswäscher 23-Waschflüssigkeitssammler.
Auf Filtern ausgewaschenes feuchtes Natriumbicarbonat wird von einem gemeinsamen Bandförderer 10 mit Pflugauswerfer 7 in den Bunker 6 der Schwingrinne 5 aufgegeben, von wo es durch die Schwingrinne und den Bandförderer 4 hindurch dem Mischer 2 zugeführt wird Zellenspeiser 3. in Zyklon 11. Der im Mischer hergestellte Thron wird in den Ringraum der Kalziniertrommel 1 geleitet. Als Ergebnis der Wärmebehandlung erhalten die Throne kalzinierte Soda und Kalzinierungsgase.
Sodaasche wird durch die Zellbeschickung 15 aus dem Kalzinator entfernt und tritt in das System der Förderer 8, 9, 16 ein. Soda wird von dem geneigten Förderer 8 durch die Beschickung in den Mischer genommen. Der Rest wird über die Sodaförderer 9, 14 dem Lager zugeführt.
Kalzinierungsgase werden aus dem Kalzinator durch den Mischer 2 entfernt, in dem mittels eines Kompressors ein Vakuum erzeugt wird.
Auf dem Weg zum Verdichter werden die Gase in den Zyklonen 11 trocken und in der Werkstatt im Brenngassammler 12 und Wäscher 22 nass gereinigt. Vor dem Wäscher werden die Brenngase im Kühlschrank 20 gekühlt schwache Flüssigkeit, die bei der Kondensation von Wasserdampf entsteht, wird dem Brenngassammler in der Kältemaschine für Brenngase zugeführt. Diese mit dem Gas in Kontakt stehende Flüssigkeit absorbiert teilweise Ammoniak und Sodastaub und läuft dann in den Sammelbehälter 19 ab. Im Kühler 20 strömt das Gas von oben nach unten durch den Ringraum, und Kühlwasser bewegt sich im Gegenstrom in den Rohren. Um ein Auskristallisieren der Kühlrohre zu verhindern und das Gas besser von Sodastaub zu spülen, wird der Ringraum mit einer schwachen Flüssigkeit gespült. Im Wäscher wird das Gas mit Wasser berieselt, zusätzlich gekühlt und vollständig von Soda und Ammoniak gewaschen.
Zur Beheizung des Calcinators wird Hochdruckdampf zugeführt. Vor der Einspeisung in den Kalzinator durchläuft es eine Reduktionskühlanlage ROU, wo seine Temperatur auf 270 °C und sein Druck auf 3 MPa reduziert werden. In den Rohren des Kalzinators kondensiert der Dampf und gibt Wärme an das kalzinierte Material ab. Das Kondensat aus dem Calcinator wird zum Kondensatsammler 17 und weiter zu den Expandern abgeführt, wo es in Niederdruckdampf umgewandelt wird.
Das technologische Schema der Sodakalzinierungstrennung bei Verwendung von Sodaöfen mit Rückführungszufuhr ist dem betrachteten ähnlich. Beim Einsatz von Öfen mit rücklauffreier Beschickung wird nasses Natriumbikarbonat durch eine spezielle Gießvorrichtung in die Ofentrommel eingebracht.
Das Mischen mit Soda findet im Ofen statt, daher ist der Mischer aus dem technologischen Schema ausgeschlossen und der Transport von Soda wird vereinfacht. Der Gehalt an Na2CO3 und Verunreinigungen in Soda hängt von der Zusammensetzung des Ausgangsnatriumbicarbonats und der Prozesstemperatur ab, letztere wird in der Regel durch die Temperatur der unbeladenen Soda bestimmt. Das Temperaturregime in Öfen wird sowohl durch die Prozessbedingungen als auch durch die Dauer der Wärmebehandlung des Materials in diesen Apparaten bestimmt.
Bei einem Trommelfüllfaktor von 0,3 beträgt die Verweildauer des Materials im Sodaumlaufofen etwa eine Stunde, im Dampfkalzinator 20-25 Minuten. Die Erhöhung der Kalzinationstemperatur in Rücklauföfen ist offensichtlich auf die Bildung von Klumpen zurückzuführen, wenn feuchtes Natriumbicarbonat mit Soda gemischt wird. Unter diesen Bedingungen ist eine Temperaturerhöhung erforderlich, um den Kalzinierungsprozess in der gesamten Masse des großen Granulats abzuschließen.
Feierabend -
Dieses Thema gehört zu:
Soda-Produktion
Bis zum Ende des achtzehnten Jahrhunderts wurde es hauptsächlich aus natürlichen Vorkommen in Ungarn, Ägypten und anderen Teilen Afrikas sowie aus Seeasche abgebaut. Die damalige Soda zeichnete sich nicht durch ihre Reinheit aus. Im Jahr 1775 hat die Französische Akademie .. Leblancs Methode Die Methode von Leblanc bestand darin, Kochsalz mit Schwefelsäuresulfat und ..
Wenn Sie zu diesem Thema weiteres Material benötigen oder nicht fündig geworden sind, empfehlen wir Ihnen die Suche in unserer Werkdatenbank:
Was machen wir mit dem erhaltenen Material:
Wenn sich dieses Material für Sie als nützlich erwiesen hat, können Sie es auf Ihrer Seite in sozialen Netzwerken speichern: